- Телефоны:
- 097 703-03-03
- 050 410-72-39
Научные статьи
доктора
Super User
Руководство по венерическим заболеваниям
Клинические рекомендации по опухолям верхних мочевыводящих путей
M. Rouprêt, M. Babjuk (председатель), M. Burger (вице-председатель), E. Compérat, N.C. Cowan, P. Gontero, A.H. Mostafid, J. Palou,
B.W.G. van Rhijn, S.F. Shariat, R. Sylvester, R. Zigeuner
Помощники в написании рекомендаций: O. Capoun, D. Cohen,
J.L. Dominguez-Escrig, B. Peyronnet, T. Seisen, V. Soukup
Перевод: Ширанов К.А.
Научное редактирование:
© Европейская ассоциация урологов, 2020
СОДЕРЖАНИЕ
- 1. ВВЕДЕНИЕ
- 1.1. Цели и задачи
- 1.2. Состав рабочей группы
- 1.3. Доступные публикации
- 1.4. История публикаций и резюме по изменениям
- 2. МЕТОДЫ
- 2.1. Поиск данных
- 2.2. Рецензирование
- 3. ЭПИДЕМИОЛОГИЯ, ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
- 3.1. Эпидемиология
- 3.2. Факторы риска
- 3.3. Гистология и классификация
- 3.3.1. Гистологические типы
- 3.4. Резюме по данным литературы и рекомендации по эпидемиологии, этиологии и патогенезу
- 4. СТАДИРОВАНИЕ И КЛАССИФИКАЦИЯ
- 4.1. Классификация
- 4.2. TNM-классификация
- 4.3. Степень злокачественности
- 4.4. Направления для дальнейшего развития
- 5. ДИАГНОСТИКА
- 5.1. Клинические симптомы
- 5.2. Методы визуализации
- 5.2.1. Компьютерная томография с контрастированием
- 5.2.2. Магнитно-резонансная томография
- 5.3. Цистоскопия и цитологическое исследование мочи
- 5.4. Диагностическая уретероскопия
- 5.5. Отдаленные метастазы
- 5.6. Резюме по данным литературы и рекомендации по диагностике переходно-клеточного рака верхних мочевыводящих путей
- 6. ПРОГНОЗ
- 6.1. Прогностические факторы
- 6.2. Предоперационные факторы
- 6.2.1. Возраст и пол
- 6.2.2. Этническое происхождение
- 6.2.3. Курение табака
- 6.2.4. Локализация, мультифокальность, размер опухоли и гидронефроз
- 6.2.5. Задержка хирургического лечения
- 6.2.6. Другие факторы
- 6.3. Послеоперационные факторы
- 6.3.1. Стадия и степень злокачественности опухоли
- 6.3.2. Поражение лимфоузлов
- 6.3.3. Лимфососудистая инвазия
- 6.3.4. Хирургический край
- 6.3.5. Патоморфологические факторы
- 6.4. Молекулярные маркеры
- 6.5. Прогностические инструменты
- 6.5.1. Внутрипузырный рецидив
- 6.6. Стратификация риска неметастатического рака верхних мочевыводящих путей
- 6.7. Резюме по данным литературы и рекомендации по прогнозу
- 7. ЛЕЧЕНИЕ
- 7.1. Локализованный рак
- 7.1.1. Органосохраняющее лечение
- 7.1.1.1. Уретероскопия
- 7.1.1.2. Чрескожный доступ
- 7.1.1.3. Сегментарная резекция мочеточника
- 7.1.1.4. Адъювантная местная терапия
- 7.1.1.5. Рекомендации по органосохраняющему лечению переходно-клеточного рака верхних мочевыводящих путей
- 7.1.2. Радикальная нефруретерэктомия
- 7.1.2.1. Хирургический доступ
- 7.1.3. Периоперационная химиотерапия в качестве дополнения к радикальной нефруретерэктомии
- 7.1.3.1. Неоадъювантная химиотерапия
- 7.1.3.2. Адъювантная химиотерапия
- 7.1.4. Адъювантная лучевая терапия после радикальной нефруретерэктомии
- 7.1.5. Адъювантная внутрипузырная химиотерапия
- 7.1.6. Резюме по данным литературы и рекомендации по лечению неметастатического рака верхних мочевыводящих путей высокого риска
- 7.1.1. Органосохраняющее лечение
- 7.2. Метастатическая болезнь
- 7.2.1. Радикальная нефруретерэктомия
- 7.2.2. Метастазэктомия
- 7.2.3. Системная химиотерапия
- 7.2.3.1. Первая линия терапии
- 7.2.3.2. Вторая линия терапии
- 7.2.4. Резюме по данным литературы и рекомендации по лечению метастатического переходно-клеточного рака ВМП
- 7.1. Локализованный рак
- 8. НАБЛЮДЕНИЕ
- 8.1. Резюме по данным литературы и рекомендации по наблюдению переходно-клеточного рака верхних мочевыводящих путей
- 9. ЛИТЕРАТУРА
- 10. КОНФЛИКТ ИНТЕРЕСОВ
- 11. ИНФОРМАЦИЯ ПО ЦИТИРОВАНИЮ
1. Введение
1.1. Цели и задачи
Рабочая группа Европейской ассоциации урологов (ЕАУ) по неинвазивному раку мочевого пузыря (НИРМП) подготовила настоящие рекомендации, чтобы дать урологам научную информацию и практические рекомендации по клиническому лечению переходно-клеточного рака верхних мочевыводящих путей (ВМП). Кроме того, доступны отдельные рекомендации ЕАУ по неинвазивному раку мочевого пузыря [1], инвазивному и метастатическому раку мочевого пузыря [2] и первичному раку уретры [3].
Необходимо подчеркнуть, что клинические рекомендации включают наиболее качественные данные, доступные в настоящее время экспертам. Однако следование рекомендациям не всегда приведет к оптимальному результату. Клинические рекомендации никогда не заменят клинический опыт при определении тактики лечения конкретного пациента, а скорее помогут направить ее с учетом персональных данных и предпочтений/конкретной ситуации больного. Рекомендации не являются обязательными для соблюдения и не рассматриваются как юридический стандарт оказания помощи.
1.2. Состав рабочей группы
Рабочая группа ЕАУ по НИРМП состоит из международной многопрофильной команды экспертов, включая уролога, онкоуролога, специалиста по лучевой диагностике, морфолога и статистика. Члены рабочей группы выбраны на основании их опыта, чтобы представлять специалистов, занимающихся лечением пациентов с подозрением на переходно-клеточный рак. Все эксперты, которые принимали участие в создании документа, направили заявление о возможном конфликте интересов, которое можно посмотреть на сайте ЕАУ: http://uroweb.org/guideline/upper-urinary-tract-urothelial-cell-carcinoma/.
1.3. Доступные публикации
Доступны краткие рекомендации как в печатном виде, так и в различных версиях для мобильных устройств на базе iOS и Android, в которых представлены основные данные из рекомендаций по раку ВМП. Это сокращенные версии, которые требуют обращения к полному тексту рекомендаций. Опубликован ряд научных статей, а также несколько переводов всех версий рекомендаций. Последняя научная статья опубликована в 2018 г. [4]. Все документы доступны на сайте ЕАУ:
http://uroweb.org/guideline/upper-urinary-tract-urothelial-cell-carcinoma/.
1.4. История публикаций и резюме по изменениям
Первые рекомендации ЕАУ по раку ВМП были опубликованы в 2011 г. Настоящее печатное издание представляет собой значительное обновление рекомендаций 2019 г. 1.4.1. Резюме по изменениям Во всем документе проведен анализ и пересмотр литературы, если это имело значение.
Во всем документе добавлены и перефразированы резюме по данным литературы и рекомендации.
Основные изменения в настоящих рекомендациях:
- Раздел 3.1 «Эпидемиология» расширен, изменен рис. 3.1 и добавлены две новые рекомендации.
3.4. Резюме по данным литературы и рекомендации по эпидемиологии, этиологии и патогенезу
| Резюме по данным литературы | УД |
|---|---|
|
Аристолохиевая кислота и курение повышают риск развития рака ВМП |
2 |
|
У пациентов с синдромом Линча повышен риск развития рака ВМП |
3 |
| Рекомендации | СР |
|---|---|
| Для выявления пациентов с переходно-клеточным раком ВМП необходимо оценивать личный и семейный анамнез на основании Амстердамских критериев | Слабая |
|
Необходимо оценивать влияние курения и воздействие аристолохиевой кислоты |
Слабая |
• Глава 6 «Прогноз»: добавлены информация и рекомендация, а также изменен рис. 6.1.
6.7. Резюме по данным литературы и рекомендации по прогнозу
| Резюме по данным литературы | УД |
|---|---|
|
Возраст не является исключающим фактором для выполнения РНУ, если операция показана в качестве радикального метода лечения |
3 |
|
Основные послеоперационные прогностические факторы включают гидронефроз, мультифокальность, размер, стадию и степень злокачественности опухоли, метастазы в лимфоузлы, лимфососудистую инвазию и редкие гистологические варианты |
3 |
| Рекомендации | СР |
|---|---|
|
Необходимо использовать предоперационные факторы для стратификации риска и определения тактики лечения |
Слабая |
• Раздел 7 «Лечение» реструктурирован, включена новая информация по адъювантной и неоадъю-
вантной химиотерапии. Кроме того, адаптированы рис. 7.1 и 7.2 и добавлены новые рекомендации.
7.1.6. Резюме по данным литературы и рекомендации по лечению неметастатического рака верхних мочевыводящих путей высокого риска
| Резюме по данным литературы | УД |
|---|---|
|
Неполное удаление стенки мочевого пузыря в области устья мочеточника повышает риск внутрипузырного рецидива |
3 |
|
Лимфодиссекция повышает выживаемость при инвазивном переходно-клеточном раке ВМП |
3 |
|
Периоперационная химиотерапия повышает выживаемость |
3 |
|
Однократная внутрипузырная химиотерапия в послеоперационном периоде снижает риск внутрипузырного рецидива |
1 |
| Рекомендации | СР< |
|---|---|
|
РНУ показана при неметастатическом переходно-клеточном раке ВМП высокого риска |
Сильная |
|
При нелокализованном переходно-клеточном раке ВМП показана открытая РНУ |
Слабая |
|
Необходимо полностью резецировать стенку мочевого пузыря в области устья мочеточника |
Сильная |
|
При переходно-клеточном раке ВМП высокого риска показана лимфодиссекция по анатомическим шаблонам |
Сильная |
|
При инвазивном переходно-клеточном раке ВМП показана периоперационная химиотерапия |
Слабая |
|
Послеоперационная внутрипузырная химиотерапия снижает риск внутрипузырного рецидива |
Сильная |
• Раздел 7.2 «Метастатическая болезнь» расширен, добавлена последняя информация по иммунотерапии в рамках первой и второй линий химиотерапии. Добавлено резюме по данным
литературы и рекомендации по лечению метастатического переходно-клеточного рака ВМП.
7.2.4. Резюме по данным литературы и рекомендации по лечению метастатического переходно-клеточного рака ВМП
| Резюме по данным литературы | УД |
|---|---|
|
РНУ у отдельных пациентов с метастатическим раком позволяет улучшить качество жизни и онкологические результаты |
3 |
|
Комбинированная химиотерапия на основе цисплатина позволяет повысить медиану выживаемости |
2 |
|
Монохимиотерапия и комбинированная химиотерапия на основе карбоплатина уступают по эффективности комбинированной химиотерапии на основе цисплатина в отношении частоты полного ответа и выживаемости |
3 |
|
Комбинированную химиотерапию без препаратов платины не сравнивали со стандартной химиотерапией у пациентов с или без противопоказаний к комбинированной химиотерапии на основе цисплатина |
4 |
|
По результатам исследования III фазы, ингибитор PD-1 пембролизумаб одобрен к применению у пациентов с прогрессированием рака во время или после комбинированной химиотерапии на основе препаратов платины |
1b |
|
По результатам исследования II фазы, ингибитор PD-L1 атезолизумаб одобрен к применению у пациентов с прогрессированием рака во время или после комбинированной химиотерапии на основе препаратов платины |
2a |
|
По результатам исследования II фазы, ингибитор PD-1 ниволумаб одобрен к применению у пациентов с прогрессированием рака во время или после комбинированной химиотерапии на основе препаратов платины |
2a |
|
По результатам исследования III фазы, ингибитор PD-1 пембролизумаб одобрен к применению у пациентов с распространенным или метастатическим переходно-клеточным раком с противопоказаниями к первой линии комбинированной химиотерапии на основе препаратов платины, однако его можно использовать только при наличии экспрессии PD-L1 |
2a |
|
По результатам исследования III фазы, ингибитор PD-L1 атезолизумаб одобрен к применению у пациентов с распространенным или метастатическим переходно-клеточным раком с противопоказаниями к первой линии комбинированной химиотерапии на основе препаратов платины, однако его можно использовать только при наличии экспрессии PD-L1 |
2a |
| Рекомендации | СРh |
|---|---|
|
РНУ показана в качестве паллиативного лечения пациентам с симптоматическим операбельным местнораспространенным раком ВМП |
Слабая |
|
Препараты первой линии для пациентов без противопоказаний к цисплатину |
|
|
Химиотерапия на основе препаратов платины включает схемы GC, MVAC, предпочтительно с Г-КСФ, высокодозный режим MVAC с Г-КСФ или PCG |
Сильная |
|
Карбоплатин и комбинированная химиотерапия без препаратов платины не показаны |
Сильная |
|
Препараты первой линии для пациентов с противопоказаниями к цисплатину |
|
|
Ингибиторы иммунных контрольных точек (пембролизумаб или атезолизумаб) необходимо назначать в зависимости от экспрессии PD-L1 |
Слабая |
|
При отсутствии экспрессии PD-L1 показана комбинированная химиотерапия на основе карбоплатина |
Сильная |
|
Препараты второй линии |
|
|
Ингибитор иммунных контрольных точек (пембролизумаб) показан пациентам с прогрессированием метастатического рака во время или после комбинированной химиотерапии на основе препаратов платины |
Сильная |
|
Ингибитор иммунных контрольных точек (атезолизумаб) показан пациентам с прогрессированием метастатического рака во время или после комбинированной химиотерапии на основе препаратов платины |
Сильная |
|
Винфлунин показан только пациентам с метастатическим раком в качестве препарата второй линии, если нельзя провести иммунотерапию или комбинированную химиотерапию. Кроме того, винфлунин можно использовать в рамках третьей или последующих линий терапии |
Сильная |
2. Методы
2.1. Поиск данных
Стандартная процедура для рабочей группы ЕАУ по рекомендациям включает ежегодную оценку новой опубликованной литературы, на основании чего проводятся последующие обновления.
В клинических рекомендациях 2020 г. по раку ВМП посредством структурированного литературного поиска найдены, сопоставлены и оценены новые и клинически значимые данные. Поиск был ограничен с 20 июня (база Кокрейновских обзоров)/26 июня (Embase) 2018 г. до 31 мая 2019 г. Поиск проводился в базе данных Pubmed, Ovid, EMBASE и центральном реестре и базе данных Кокрейновских систематических обзоров. После дедубликации найдены и проанализированы 702 статьи.
Из полученных статей исключены базовые исследования, серии случаев, отчеты и комментарии редакторов. Включены только исследования взрослых пациентов, результаты которых опубликованы на английском языке. Найденные публикации в основном имели ретроспективный характер, включая ряд крупных многоцентровых исследований. Вследствие недостаточного количества рандомизированных данных статьи отбирались по следующим критериям: развитие концепции, промежуточные и отдаленные клинические результаты, качество и важность исследований.
Всего 56 статей включены в обновление настоящих рекомендаций. Старые исследования включали, только если они имели историческое значение. Поисковая стратегия опубликована по адресу:
http://uroweb.org/guideline/upper-urinary-tract-urothelial-cell-carcinoma/?type=appendices-publications.
В разделах 3–6 («Эпидемиология, этиология и патогенез», «Стадирование и классификация», «Диагностика и прогноз») литература оценивалась по уровню доказательности (УД), а рекомендации градировали по степени (СР) согласно классификации Оксфордского центра медицинских исследований, основанной на доказательствах [5]. В разделах 7 и 8 («Лечение» и «Наблюдение») использовали систему, модифицированную из классификации Оксфордского центра медицинских исследований, основанной на доказательствах, 2009 г. [5].
Для каждой рекомендации в онлайн-режиме заполняется форма для определения силы, с учетом ряда основных элементов, на основании модифицированной методологии GRADE [6, 7].
Сила рекомендаций определяется с учетом следующих основных элементов:
- общее качество данных в поддержку рекомендаций; ссылки, используемые в этом тексте, градируются по степени согласно системе, модифицированной из классификации Оксфордского центра медицинских исследований, основанной на доказательствах (см. выше) [5];
- выраженность эффекта (индивидуальный или комбинированный эффект);
- убедительность результатов (точность, согласованность, неоднородность и другие статистические или связанные с исследованиями факторы);
- баланс между желательными и нежелательными исходами;
- влияние ценностей и предпочтений пациента на вмешательство;
- точность этих ценностей и предпочтений пациента.
Эти основные элементы стали основой, которую рабочая группа использует для определения силы каждой рекомендации. Она в свою очередь описана терминами «сильная» или «слабая». Сила каждой рекомендации определяется балансом между желательными и нежелательными последствиями альтернативных стратегий, качеством данных (включая точность критериев) и природой и вариабельностью ценностей и предпочтений пациентов [8]. С целью консультирования таблицы опубликованы онлайн.
Дополнительную информацию по методологии можно найти в общем разделе «Методология» настоящего печатного издания или в онлайн-версии на сайте ЕАУ: http://www.uroweb.org/guideline/. По указанному адресу также можно просмотреть список ассоциаций, которые оказали поддержку в составлении рекомендаций ЕАУ.
2.2. Рецензирование
Рекомендации прошли рецензирование перед публикацией в 2016 г. Обзорная статья была прорецензирована перед публикацией в 2018 г. [4].
3. Эпидемиология, этиология и патогенез
3.1. Эпидемиология
В развитых странах переходно-клеточный рак занимает 4-е место по распространенности [9]. Он может развиваться как в нижних (в мочевом пузыре или уретре), так и в верхних мочевыводящих путях (ВМП) (в чашечно-лоханочной системе или мочеточнике). Рак мочевого пузыря (РМП) составляет 90–95% всех случаев переходно-клеточного рака и является наиболее распространенной злокачественной опухолью мочевыводящих путей [1]. Переходно-клеточный рак ВМП встречается довольно редко и составляет 5–10% всех случаев переходно-клеточного рака [9] с установленными ежегодными показателями в западных странах почти 2 случая на 100 000 населения. Эти показатели увеличились за последние несколько десятилетий в результате улучшения диагностики и повышения выживаемости пациентов с РМП [10].
Опухоли чашечно-лоханочной системы почки встречаются в 2 раза чаще, чем опухоли мочеточника, а многофокусные опухоли наблюдаются в 10–20% случаев [11]. У 11–36% пациентов выявляется сопутствующая карцинома in situ [10], а в 17% случаев одновременно диагностируется РМП [12]. У 41% мужчин в Америке в анамнезе имеется РМП по сравнению с 4% мужчин в Китае [13]. Этим, наряду с генетическими и эпигенетическими факторами, можно объяснить, почему у пациентов в Азии при первичной диагностике рак имеет более высокую стадию и степень злокачественности по сравнению с другими этническими группами [10].
Рецидив в мочевом пузыре встречается у 22–47% пациентов с раком ВМП [14], а рецидив с контралатеральной стороны – только в 2–6% случаев [15].
В исследовании, включавшем 82 пациента с РМП, которым через 1–3 года после БЦЖ-терапии проводилась визуализация ВМП, частота переходно-клеточного рака составила 13%. Все случаи были бессимптомными [16]. В другом исследовании (n = 307) без рутинной визуализации ВМП частота рака составила 25% [17]. В многоцентровом когортном исследовании (n = 402) с длительностью наблюдения 50 месяцев переходно-клеточный рак ВМП выявлен у 7,5% пациентов с неинвазивным РМП, которым проводилась БЦЖ-терапия. Прогностическими факторами были внутрипузырный рецидив и непапиллярный характер роста опухоли во время трансуретральной резекции [16]. После радикальной цистэктомии, выполненной по поводу инвазивного РМП, у 3–5% больных развивается метахронный переходно-клеточный рак ВМП.
Около 60% переходно-клеточных опухолей ВМП являются инвазивными на момент диагностики по сравнению с 15–25% при РМП [18], а у 7% пациентов выявляются метастазы [10, 19].
Пик заболеваемости приходится на возраст от 70 до 90 лет, и у мужчин эти опухоли встречаются втрое чаще, чем у женщин [20].
При переходно-клеточном раке ВМП и РМП имеются сильные различия по частоте основных геномных нарушений. У пациентов с обоими раками в анамнезе они всегда развиваются из одного клона клеток. Анализ геномных нарушений при переходно-клеточном раке ВМП дает информацию о риске внутрипузырного рецидива и позволяет выявить опухоли, связанные с синдромом Линча [21].
Амстердамские критерии представляют собой диагностические критерии, используемые для выявления семей с вероятным наличием синдрома Линча [22]. При переходно-клеточном раке ВМП, связанном с синдромом Линча, иммуногистохимический анализ в 98% случаев показывает отсутствие экспрессии белков, предрасполагающей к мутации генов, ответственных за ошибки репарации ДНК (46% с микросателлитной нестабильностью и 54% с микросателлитной стабильностью) [23]. Большинство опухолей развиваются у носителей мутации MSH2 [24]. Пациентам с высоким риском синдрома Линча необходимо провести секвенирование ДНК и консультированиеродственников [25, 26]. Характерные для синдрома Линча наследственные мутации в ДНК генов,ответственных за ошибки репарации ДНК, определяются у 9% пациентов с переходно-клеточнымраком ВМП по сравнению с 1% больных РМП, что свидетельствует о связи переходнолеточного рака ВМП и синдрома Линча [27]. В исследовании, включавшем 115 последовательных пациентов с переходно-клеточным раком ВМП, результат скрининга на синдром Линча был положительным в 13,9% случаев, а в 5,2% случаев синдром был подтвержден [28]. Это один из наиболее высоких показателей невыявленного генетического заболевания при урологических опухолях, который оправдывает скрининг всех пациентов с переходно-клеточным раком ВМП младше 65 лет и больных с отягощенным семейным анамнезом (см. рис. 3.1) [29, 30].

Рис. 3.1. Отбор пациентов с раком верхних мочевыводящих путей на скрининг наследственных форм во время первичного сбора анамнеза
3.2. Факторы риска
Существует большое количество факторов окружающей среды, способствующих развитию перероли данных факторов, за исключением курения и аристолохиевой кислоты. Курение табака увеличивает риск развития переходно-клеточного рака ВМП в 2,5–7 раз [32–34]. В крупном популяционном исследовании, включавшем 229 251 «случай» и 1 197 552 подобранных «контроля», в котором оценивали семейные случаи переходно-клеточного рака, выявлены генетические или связанные с окружающей средой факторы, независимо от статуса курения. Хотя более чем у 9% участников диагностирован переходно-клеточный рак ВМП, семейных случаев не определялось, что может свидетельствовать о наличии семейных случаев только при переходно-клеточном раке нижних мочевыводящих путей [35].
На Тайване наличие мышьяка в питьевой воде связано с переходно-клеточным раком ВМП [36]. Аристолохиевая кислота, нитрофенантрен-карболовая кислота, выделяемая из растения Aristolochia, оказывает различные эффекты на мочевыводящую систему. Аристолохиевая кислотанеобратимо повреждает проксимальные канальцы, приводя к хроническим тубулоинтерстици альным заболеваниям, а мутагенные свойства аристолохиевой кислоты преимущественно приводят к переходно-клеточному раку ВМП [37–39]. Недавно описана связь аристолохиевой кислоты с РМП, почечно-клеточным раком, печеночно-клеточным раком и внутрипеченочной холангиокарциномой [40]. Описано два пути воздействия аристолохиевой кислоты: (i) загрязнения сельскохозяйственных культур растениями Aristolochia, как описано при балканской эндемической нефропатии [41]; и (ii) употребление лекарственных трав на основе Aristolochia [42, 43]. Препаратырастения Aristolochia используются по всему миру, особенно в Китае и на Тайване [39]. После биологической активации аристолохиевая кислота воздействует на геномную ДНК с формированием аддуктов деоксиаденозин-аристолактама [44]; данные изменения сохраняются в тканях-мишенях на протяжении десятилетий, выступая в роли достоверных биомаркеров воздействия [9]. Аддукты создают уникальный спектр мутаций, характеризующийся трансверсиями A→T, локализующимися преимущественно на нетранскрибируемом участке ДНК [40, 45]. Переходно-клеточный рак ВМП развивается менее чем у 10% лиц, контактирующих с аристолохиевой кислотой [38].
В двух ретроспективных исследованиях показано, что переходно-клеточный рак ВМП, связанный с аристолохиевой кислотой, чаще встречается у женщин [46, 47], хотя прогноз у них более благоприятный, чем у мужчин.
Потребление алкоголя является независимым фактором риска переходно-клеточного рака ВМП. В крупном исследовании типа «случай – контроль» (1569 «случаев» и 506 797 «контролей») показано статистически значимое увеличение риска у пациентов, употреблявших алкоголь, по сравнению с лицами, никогда не употреблявшими алкоголь (отношение шансов 1,23; 95% ДИ 1,08–1,40; p = 0,001). Пороговый показатель для повышения риска составляет 15 г алкоголя в сутки. Кроме того, эффект носит дозозависимый характер [48].
Различия в способности взаимодействия канцерогенов могут объяснять восприимчивость к развитию переходно-клеточного рака. Поскольку определенный генетический полиморфизм может быть связан с увеличением риска развития и прогрессирования болезни, имеет значение вариабельность в индивидуальной восприимчивости к указанным выше факторам риска. Переходноклеточный рак ВМП и РМП могут иметь общие факторы риска развития или общие механизмы повреждения молекулярных путей [21]. К настоящему времени описано два случая полиморфизма, специфичного для рака ВМП [49].
3.3. Гистология и классификация
3.3.1. Гистологические типы
Опухоли ВМП с непереходно-клеточной морфологической структурой встречаются довольно редко [50, 51], но различные морфологические варианты могут наблюдаться почти в 25% случаев [52, 53]. Плоскоклеточный рак мочевыводящих путей чаще встречается при хроническом воспалении и инфекции, связанных с мочекаменной болезнью [54–57]. Плоскоклеточный рак ВМП встречается примерно в 15% случаев опухолей [55]. Они всегда относятся к опухолям высокой степени злокачественности и имеют менее благоприятный прогноз по сравнению с чистым переходно-клеточным раком [53, 58]. Другие, более редкие гистологические варианты включают саркоматоидную карциному и переходно-клеточный рак с инвертированным ростом [59].
Карцинома собирательных трубочек имеет аналогичные с переходно-клеточным раком
ВМП характеристики, но отличается уникальной транскриптомной сигнатурой, относящейся к почечно-клеточному раку, с предполагаемым происхождением из клеток дистальных извитых канальцев [35]. По этой причине она относится к раку почки, а не раку ВМП [60].
3.4. Резюме по данным литературы и рекомендации по эпидемиологии, этиологии и патогенезу
| Резюме по данным литературы | УД |
|---|---|
|
Аристолохиевая кислота и курение повышают риск развития рака ВМП |
2 |
|
У пациентов с синдромом Линча повышен риск развития рака ВМП |
3 |
| Рекомендации | СР |
|---|---|
| Для выявления пациентов с переходно-клеточным раком ВМП необходимо оценивать личный и семейный анамнез на основании Амстердамских критериев | Слабая |
|
Необходимо оценивать влияние курения и воздействие аристолохиевой кислоты |
Слабая |
4. Стадирование и классификация
4.1. Классификация
Классификация и морфология переходно-клеточного рака ВМП сходны с таковыми при РМП [1]. Выделяют неинвазивные папиллярные опухоли (папиллярные переходно-клеточные опухоли с низким злокачественным потенциалом, папиллярный переходно-клеточный рак низкой и высокой степени злокачественности) [61], плоские новообразования (карцинома in situ – CIS) и инвазивный рак. Как и при опухоля мочевого пузыря, непереходно-клеточные варианты являются неблагоприятным фактором риска.
4.2. TNM-классификация
В таблице 1 представлена TNM-классификация [62]. В качестве регионарных лимфатических узлов (ЛУ) рассматриваются ЛУ ворот почки и забрюшинные ЛУ, а для средней или нижней трети мочеточника – тазовые ЛУ. Сторона поражения не влияет на стадию N.
4.3. Степень злокачественности
В 2004 г. ВОЗ и Международное общество урологической патологии (ISUP) опубликовали новую классификацию неинвазивных переходно-клеточных опухолей, в которой представлена другая стратификация пациентов по сравнению с классификацией ВОЗ 1973 г. [63, 64]. При этом в 2016 г. опубликовано обновление системы градации ВОЗ 2004 г., в котором не было значимых изменений [63].
Настоящие рекомендации по-прежнему основаны на классификации 1973 и 2004/2016 гг., поскольку в большинстве публикаций используется классификация 1973 г. [61].
4.4. Направления для дальнейшего развития
В исследованиях, посвященных молекулярной классификации, при оценке экспрессии ДНК, РНК и протеинов выделены генетически различные группы опухолей. Описано четыре молекулярных подтипа с различным злокачественным потенциалом, однако при этом неизвестно, влияют ли молекулярные характеристики на эффективность лечения [65].
Таблица 1. TNM-классификация 2017 г. для переходно-клеточного рака ВМП [62]
T – первичная опухоль
Тх первичная опухоль не может быть оценена
Т0 нет данных за наличие первичной опухоли
Та неинвазивный папиллярный рак
Tis carcinoma in situ
Т1 опухоль вовлекает субэпителиальную соединительную ткань
Т2 опухоль поражает мышечный слой
Т3 (почечная лоханка) опухоль прорастает за пределы мышечной оболочки
в перипельвикальную жировую ткань или почечную паренхиму (мочеточник) опухоль
прорастает за пределы мышечного слоя в периуретральную жировую клетчатку
Т4 опухоль вовлекает соседние органы или прорастает через почку в паранефральную
клетчатку
N – регионарные ЛУ
Nх регионарные ЛУ не могут быть оценены
N0 нет метастазов в регионарных ЛУ
N1 метастаз в одном ЛУ не более 2 см в наибольшем измерении
N2 метастаз в одном ЛУ более 2 см или несколько метастазов в ЛУ
М – отдаленные метастазы
М0 нет отдаленных метастазов
М1 есть отдаленные метастазы
5. Диагностика
5.1. Клинические симптомы
Диагноз переходно-клеточного рака ВМП может быть установлен случайно или при обследовании по поводу симптомов, которые, как правило, ограничены. Самым частым симптомом при переходно-клеточном раке ВМП является макро- или микрогематурия (70–80%) [66, 67]. Боль в боку встречается в 20% случаев [68, 69]. При переходно-клеточном раке ВМП могут появляться системные симптомы (анорексия, потеря массы тела, недомогание, тошнота, лихорадка, ночная потливость или кашель), которые должны служить причиной для более глубокого обследования c целью исключения метастазов; они связаны с неблагоприятным прогнозом [68, 69].
5.2. Методы визуализации
5.2.1. Компьютерная томография с контрастированием
Компьютерная томография (КТ) с контрастированием имеет самую высокую диагностическую точность при раке ВМП из всех доступных методов [70]. Согласно данным метаанализа 13 исследований, включавших 1233 пациента, объединенная чувствительность КТ-урографии в диагностике переходно-клеточного рака ВМП составляет 92% (ДИ 88–98), а объединенная специфичность – 95% [71].
Быстрая съемка тонких срезов позволяет получить изотропное изображение с высоким разрешением, которое можно рассматривать в самых разных плоскостях, что помогает поставить диагноз, не ухудшая разрешающую способность. Плоские опухоли при КТ-урографии практически не выявляются, если только они не вызывают массивную инфильтрацию или утолщение стенок.
Наличие увеличенных ЛУ является сильным прогностическим фактором метастазов [72].
5.2.2. Магнитно-резонансная томография
Магнитно-резонансная (МР) урография показана тем пациентам, которым нельзя выполнить КТ с контрастированием, как правило при противопоказаниях к лучевой нагрузке или введению йодсодержащих контрастных препаратов [73]. Чувствительность МР-урографии для опухолей размером менее 2 см после введения контрастного вещества составляет 75% [73]. Проведение МРТ с введением контрастных веществ, содержащих гадолиний, противопоказано пациентам с тяжелой почечной недостаточностью (клиренс креатинина менее 30 мл/мин), учитывая высокий риск нефрогенного системного фиброза. КТ-урография является более предпочтительным методом в диагностике рака ВМП, чем МР-урография.
5.3. Цистоскопия и цитологическое исследование мочи
Уретроцистоскопия является важнейшей частью диагностики переходно-клеточного рака ВМП для исключения сопутствующего РМП [10, 12]. Положительное цитологическое исследование мочи при нормальных результатах цистоскопии мочевого пузыря и исключении карциномы in situ в мочевом пузыре или простатическом отделе уретры позволяет с высокой степенью вероятности предположить наличие рака ВМП [1, 74, 75]. Цитология менее чувствительна к раку ВМП, чем к РМП, и идеальный вариант подразумевает выполнение ее in situ в лоханке [76]. Ретроградная уретеропиелография остается одним из вариантов диагностики опухоли ВМП [70, 77, 78]. Цитологическое исследование мочи из лоханки и мочеточника желательно выполнять до введения значительного количества контрастного вещества для ретроградной уретеропиелографии, поскольку контрастное вещество может испортить цитологические образцы [78, 79]. Цитологическое исследование с перемешиванием позволяет выявить до 91% злокачественных опухолей, что сопоставимо с гистологическим исследованием биопсийного материала [80].
Чувствительность флуоресцентной гибридизации in situ (FISH) для выявления молекулярных изменений, характерных для рака ВМП, составляет около 50%, и по этой причине данный метод не рекомендуется для рутинной клинической практики [81–83].
5.4. Диагностическая уретероскопия
Для визуализации и биопсии мочеточника и чашечно-лоханочной системы почки используется гибкая уретероскопия. Уретероскопия позволяет оценить наличие, внешний вид и размер опухоли. Биопсия позволяет определить степень злокачественности в 90% случаев с низким уровнем ложноотрицательных результатов вне зависимости от размера образца [84]. Диагностическая биопсия может привести к занижению степени злокачественности, что требует тщательного наблюдения в том случае, если проводится органосохраняющее лечение [85]. Уретероскопия также дает возможность селективно взять материал для цитологического исследования с целью выявления карциномы in situ [78, 86, 87]. Оценка стадии при биопсии, выполненной во время уретероскопии, может быть затруднительной.
Комбинация степени злокачественности по данным биопсии, изменений при инструмен тальной диагностике, например гидронефроза, и цитологического исследования мочи помогает сделать выбор между РНУ и эндоскопическим лечением [87, 88]. Хотя результаты двух исследований свидетельствуют о повышении риска внутрипузырного рецидива у пациентов, которым перед РНУ проводилась уретероскопия [88, 89], в другой публикации получены противоположные результаты [91].
Техническое развитие гибких уретероскопов и использование новейших технологий визуализации улучшают качество изображения и диагностику плоских образований [89]. Наиболее перспективной технологией является узкополосная визуализация (NBI), но к настоящему времени получены только предварительные результаты [88, 93, 94]. Оптическая когерентная томография и конфокальная лазерная эндомикроскопия (Cellvizio©) используются in vivo для оценки степени злокачественности и/или стадии опухоли и/или для стадирования и имеют хорошую корреляцию с послеоперационным заключением при раке высокой степени злокачественности [95, 96]. В разделе 5.6 приводятся рекомендации по диагностике.
5.5. Отдаленные метастазы
Перед радикальным лечением важно исключать наличие отдаленных метастазов. КТ и МРТ являются методами выбора для выявления поражения легких и органов брюшной полости [71].
5.6. Резюме по данным литературы и рекомендации по диагностике переходно-клеточного рака верхних мочевыводящих путей
| Резюме по данным литературы | УД |
|---|---|
|
Диагностика переходно-клеточного рака ВМП основана на КТ-урографии и уретероскопии. |
2 |
|
Селективное цитологическое исследование мочи имеет высокую чувствительность в выявлении опухолей высокого риска, включая карциному in situ |
3 |
|
Уретроцистоскопия позволяет выявить сопутствующий РМП |
2 |
| Рекомендации | СР |
|---|---|
|
Для исключения сопутствующего рака мочевого пузыря необходимо выполнить уретроцистоскопию |
Сильная |
|
В рамках диагностического поиска и стадирования рекомендуется выполнить КТ-урографию |
Сильная |
|
Диагностическая уретероскопия с биопсией показана в случае неубедительного результата методов визуализации и цитологического исследования мочи и/или при необходимости стратификации риска опухоли |
Сильная |
|
При наличии противопоказаний к КТ показана МР-урография |
Сильная |
6. Прогноз
6.1. Прогностические факторы
При прорастании мышечной стенки переходно-клеточный рак ВМП, как правило, имеет неблагоприятный прогноз. Показатели пятилетней канцероспецифической выживаемости у пациентов с опухолями стадии pT2/pT3 составляют < 50% по сравнению с < 10% при стадии pT4 [97–100].
Ниже описаны основные прогностические факторы; на рис. 6.1 представлен обширный список факторов.
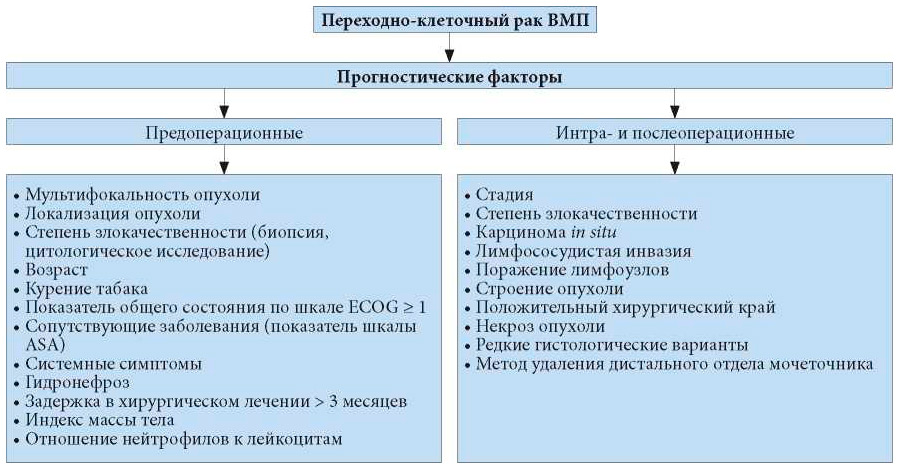
Рис. 6.1. Переходно-клеточный рак верхних мочевыводящих путей – прогностические факторы
6.2. Предоперационные факторы
6.2.1. Возраст и пол
Возраст пациента на момент выполнения РНУ независимо связан со снижением канцероспецифической выживаемости [98, 101, 102] (УД: 3). Значительную часть пожилых пациентов можно излечить с помощью РНУ [103], вследствие чего возраст сам по себе не должен быть причиной отказа от радикального лечения [102, 103]. Пол больше не считается независимым прогностическим фактором, влияющим на смертность от рака ВМП [20, 98, 104].
6.2.2. Этническое происхождение
В одном многоцентровом исследовании не выявлено межрасовых различий [105], но в популяционных исследованиях показано, что у пациентов афроамериканской расы результаты лечения хуже, чем у лиц другого этнического происхождения (УД: 3). В другом исследовании показаны различия между пациентами в Китае и США при диагностике рака (факторы риска, характеристики заболевания и прогностические факторы неблагоприятных исходов) [13].
6.2.3. Курение табака
Курение на момент постановки диагноза повышает риск рецидива и смертности после РНУ [106, 107], а также повышает риск внутрипузырного рецидива [108] (УД: 3). Описана тесная взаимосвязь между курением табака и прогнозом; отказ от курения благоприятно влияет на онкологические показатели.
6.2.4. Локализация, мультифокальность, размер опухоли и гидронефроз
Первичная локализация опухоли является прогностическим фактором [109, 110] (УД: 3). После поправки на стадию опухоли при многоочаговых опухолях и опухолях мочеточника прогноз хуже, чем при опухолях лоханки [98, 109–114]. Гидронефроз связан с распространенным процессом и неблагоприятными онкологическими результатами [68, 72, 79].
6.2.5. Задержка хирургического лечения
Задержка между диагностикой инвазивной опухоли и ее удалением может повышать риск прогрессирования. Временная граница от выбора РНУ до ее выполнения не должна превышать 12 недель [115–119] (УД: 3).
6.2.5. Задержка хирургического лечения
Задержка между диагностикой инвазивной опухоли и ее удалением может повышать риск прогрес сирования. Временная граница от выбора РНУ до ее выполнения не должна превышать 12 недель [115–119] (УД: 3).
6.2.6. Другие факторы
Показатель шкалы Американского общества анестезиологов (ASA) статистически значимо коррелирует с канцероспецифической выживаемостью после РНУ [120] (УД: 3), так же как и показатель шкалы ECOG [121]. Ожирение и повышенный индекс массы тела отрицательно влияют на канцероспецифическую выживаемость [122] (УД: 3). Высокое отношение нейтрофилов к лимфоцитам до лечения [123, 124] и низкий уровень альбумина [125] также коррелируют с более высокой канцероспецифической смертностью.
6.3. Послеоперационные факторы
6.3.1. Стадия и степень злокачественности опухоли
Основными прогностическими факторами являются стадия и степень злокачественности опухоли [18, 87, 98, 126, 127].
6.3.2. Поражение лимфоузлов
Поражение ЛУ и экстранодальное прорастание являются сильными прогностическими факторами результатов лечения рака ВМП [128, 129]. Лимфодиссекция во время РНУ позволяет лучше стадировать процесс [100, 129–131] (УД: 3), но ее лечебная роль остается противоречивой.
6.3.3. Лимфососудистая инвазия
Лимфососудистая инвазия определяется примерно в 20% случаев рака ВМП и является независимым прогностическим фактором выживаемости [132–134]. Статус лимфососудистой инвазии следует систематически включать в протокол патоморфологического исследования после РНУ [132, 135, 136] (УД: 3).
6.3.4. Хирургический край
Положительный хирургический край в мягких тканях после РНУ является важным фактором развития метастазов. Патоморфологи должны искать и описывать положительный край на уровне удаления мочеточника, краев стенки мочевого пузыря и вокруг края опухоли [137] (УД: 3).
6.3.5. Патоморфологические факторы
Обширный некроз опухоли (> 10%) является независимым прогностическим фактором у пациентов, которым проводят РНУ [138, 139] (УД: 3). Кроме того, строение опухоли также является сильным прогностическим фактором, поскольку наличие опухоли на широком основании связанос неблагоприятным прогнозом [140, 141] (УД: 3). Наличие сопутствующей карциномы in situ при локализованном переходно-клеточном раке ВМП связано с повышением риска рецидива и канцероспецифической смертности [142, 143] (УД: 3). Макроскопическая инфильтрация или инвазия окололоханочной жировой клетчатки связана с более высоким риском рецидива после РНУ по сравнению с микроскопической инфильтрацией паренхимы почки [52, 144].
6.4. Молекулярные маркеры
В ряде исследований оценивали прогностическое влияние различных тканевых маркеров, связанных с клеточной адгезией (Е-кадерин [145] и CD24), микросателлитной нестабильностью [146], клеточной дифференциацией [147, 148], ангиогенезом, клеточной пролиферацией (Ki67), эпителиально-мезенхимальным переходом, митозом, апоптозом, сосудистой инвазией, экспрессией рецептора программируемой клеточной смерти (лиганда) 1 (PD-1/PDL-1) [149] и белком c-MET [98, 150].
Однако в связи с редкостью заболевания основными ограничениями вышеприведенных исследований являются их ретроспективный характер и небольшой размер выборки. В настоящее время ни один из маркеров не соответствует критериям, необходимым для использования в клинической практике с целью определения тактики лечения.
6.5. Прогностические инструменты
В настоящее время предложены три модели для предоперационного прогнозирования мышечноинвазивного/нелокализованного рака [151–153].
Кроме того, описано пять прогностических номограмм на основании стандартных морфологических характеристик [100, 154–158].
6.5.1. Внутрипузырный рецидив
В метаанализе выявлены статистически значимые прогностические факторы внутрипузырного рецидива после РНУ [159] (УД: 3). Описаны три категории факторов повышенного риска рецидива:
- характеристики пациента (мужской пол, РМП в анамнезе, курение, хроническая болезнь почек до операции);
- характеристики опухоли (положительный результат цитологического исследования, локализация опухоли в мочеточнике, мультифокальность, инвазивная стадия, некроз);
- факторы лечения, включая технику (лапароскопический доступ, экстравезикальное иссечение устья) и положительный хирургический край [159].
Кроме того, диагностическая уретероскопия повышает риск внутрипузырного рецидива после РНУ [89, 90] (УД: 3). На основании публикаций с низким уровнем доказательности можно сделать вывод, что однократная инстилляция после диагностической/лечебной уретероскопии при неметастатическом переходно-клеточном раке ВМП позволяет снизить риск внутрипузырного рецидива, аналогично ее выполнению после РНУ [119–121].
6.6. Стратификация риска неметастатического рака верхних мочевыводящих путей
Поскольку при переходно-клеточном раке ВМП трудно клинически оценить стадию опухоли, следует стратифицировать опухоли в группу низкого и высокого риска, чтобы отобрать пациентов, которым можно проводить органосохраняющее лечение [160, 161] (рис. 6.2).
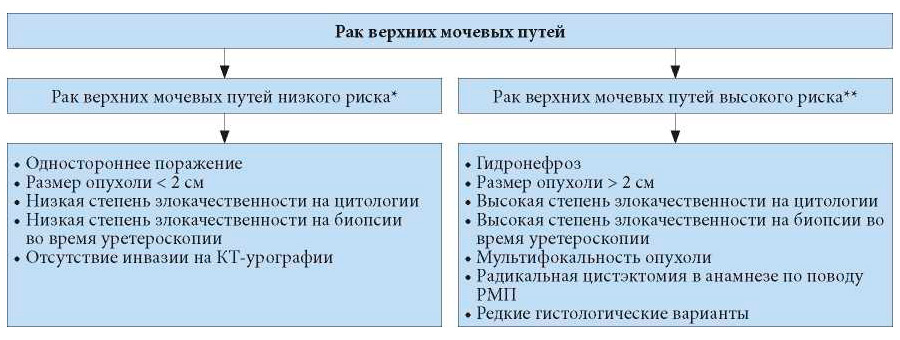
* Должны присутствовать все факторы.
** Может присутствовать один из этих факторов.
Рис. 6.2. Стратификация риска рака верхних мочевыводящих путей перед вмешательством
6.7. Резюме по данным литературы и рекомендации по прогнозу
| Резюме по данным литературы | УД |
|---|---|
|
Возраст не является исключающим фактором для выполнения РНУ, если операция показана в качестве радикального метода лечения |
3 |
|
Основные послеоперационные прогностические факторы включают гидронефроз, мультифокальность, размер, стадию и степень злокачественности опухоли, метастазы в лимфоузлы, лимфососудистую инвазию и редкие гистологические варианты |
3 |
| Рекомендации | СР |
|---|---|
|
Необходимо использовать предоперационные факторы для стратификации риска и определения тактики лечения |
Слабая |
7. Лечение
7.1. Локализованный рак
7.1.1. Органосохраняющее лечение
Органосохраняющее лечение рака ВМП позволяет избавить пациента от риска осложнений, связанных с РНУ, и при этом не ухудшить онкологические результаты и сохранить функцию почки, как показано в метаанализе, проведенном рабочей группой по НИРМП [162]. При раке низкого риска оно является предпочтительным подходом, при котором показатели выживаемости сопоставимы с РНУ [162]. Его необходимо предлагать во всех случаях низкого риска вне зависимости от состояния контралатеральной почки. При опухолях высокой степени злокачественности органосохра няющее лечение показано в отдельных случаях (при почечной недостаточности или единственной функционирующей почке) (УД: 3).
Рекомендации по органосохраняющему лечению переходно-клеточного рака ВМП представлены в разделе 7.1.1.5.
7.1.1.1. Уретероскопия
При раке низкого риска можно проводить эндоскопическое лечение [163, 164]. Для удаления опухолей чашечно-лоханочной системы требуется гибкий уретероскоп [165]. Пациента необходимо информировать о выполнении ранней (повторной) уретероскопии [166] и более тщательного и строгого наблюдения. В таких случаях требуется полная резекция или деструкция опухоли [166]. Тем не менее сохраняется риск прогрессирования рака после эндоскопического лечения из-за низкой точности методов визуализации и биопсии для стратификации риска и определения биологического поведения опухоли [167].
7.1.1.2. Чрескожный доступ
Чрескожное лечение можно рассматривать при опухолях лоханки почки низкого риска [164, 168] (УД: 3). Оно показано при локализации рака низкого риска в нижней чашке, к которой невозможно или трудно добраться гибким уретерореноскопом. Однако данный подход стали использовать реже в связи с улучшением материалов и модернизацией эндоскопов с отклонением дистального конца [164, 168]. Чрескожный доступ сопровождается риском имплантационных метастазов.
7.1.1.3. Сегментарная резекция мочеточника
Сегментарная резекция мочеточника с широким иссечением краев позволяет получить материал для определения стадии и степени злокачественности и сохранить ипсилатеральную почку. Во время сегментарной резекции можно выполнить лимфодиссекцию [162]. Сегментарная резекция проксимальных двух третей мочеточника связана с более высокой частотой рецидива, чем резекция дистальной трети [169, 170] (УД: 3).
Полная резекция дистального отдела мочеточника с неоцистостомой показана при опухолях дистального отдела мочеточника низкого риска, если они не могут быть удалены полностью эндоскопически, и при опухолях высокого риска, когда органосохраняющее лечение необходимо для сохранения функции почки [99, 169, 170] (УД: 3). Полное удаление мочеточника с замещением сегментом подвздошной кишки технически выполнимо, но показано лишь в тех случаях, когда обязательно необходимо органосохраняющее лечение у пациентов с раком низкого риска [171].
Открытая резекция лоханки или резекция почки практически не имеет показаний. Открытая резекция опухолей чашечно-лоханочной системы практически не выполняется.
7.1.1.4. Адъювантная местная терапия
В исследованиях изучалось антеградное введение вакцины БЦЖ (бациллы Кальметта–Герена) или митомицина C через нефростому при карциноме in situ (после полного удаления опухоли) [143, 172] (УД: 3). Кроме того, можно использовать ретроградное введение по мочеточниковому катетеру, но антеградный и ретроградный доступы несут определенный риск вследствие возможной обструкции мочеточника с развитием пиеловенозного рефлюкса во время инстилляции/перфузии. Хотя можно использовать рефлюкс препарата по стенту с двойным J-концом, это не рекомендуется, поскольку он часто не достигает почечной лоханки [173–176]. Недавно опубликованы систематический обзор и метаанализ, в которых оценивали онкологические результаты у пациентов с папиллярным переходно-клеточным раком ВМП или карциномой in situ ВМП. Пациентам проводились органосохраняющее лечение и адъювантная внутриполостная терапия. Авторы оценивали влияние адъювантной терапии (химиотерапевтические препараты и/или иммунотерапия с БЦЖ-терапией) после органосохраняющего лечения папиллярного переходно-клеточного рака ВМП (Ta-T1) и адъювантной БЦЖ-терапии при карциноме in situ. Результаты свидетельствуют о сопоставимой эффективности различных методов введения (антеградный, ретроградный, комбинированный) в отношении частоты рецидива, прогрессирования, канцероспецифической и общей выживаемости.
Следует отметить, что частота рецидива после адъювантной инстилляции сравнима с литературными данными для пациентов, не получавших адъювантного лечения, что ставит под сомнение его эффективность [177]. В анализ были включены ретроспективные исследования с небольшим числом пациентов, предвзятостью публикаций и неточностями в описании результатов.
7.1.1.5. Рекомендации по органосохраняющему лечению переходно-клеточного рака верхних мочевыводящих путей
| Рекомендации | СР |
|---|---|
|
Органосохраняющее лечение является предпочтительным вариантом для пациентов с опухолями низкого риска |
Сильная |
|
Органосохраняющее лечение опухолей высокого риска возможно только при локализации в дистальном отделе мочеточника |
Слабая |
|
Пациентам с единственной почкой и/или нарушением функции почек показано органосохраняющее лечение, если оно не нарушает онкологические результаты. Выбор тактики лечения проводится на индивидуальной основе, с активным участием пациента |
Сильная |
7.1.2. Радикальная нефруретерэктомия
7.1.2.1. Хирургический доступ
7.1.2.1.1. Открытая радикальная нефруретерэктомия
РНУ с резекцией устья представляет собой стандарт лечения при раке высокой степени злокачественности, вне зависимости от локализации опухоли [18] (УД: 3). РНУ должна соответствовать принципам онкологии, которые включают антибластику посредством недопущения входа в мочевыводящие пути во время резекции опухоли [18]. В разделе 7.1.6 представлены рекомендации по РНУ.
7.1.2.1.2. Лапароскопическая радикальная нефруретерэктомия
В литературе описаны случаи диссеминации в забрюшинном пространстве и по ходу расположения троакаров при удалении опухолей больших размеров в условиях пневмоперитонеума [178, 179].
Необходимо соблюдать несколько правил, чтобы избежать диссеминации опухоли при лапароскопической операции:
- избегать нарушения целостности мочевыводящих путей;
- избегать прямого контакта инструментов с опухолью;
- лапароскопическая РНУ должна проходить в закрытой системе. Нельзя морцеллировать опухоль, а для извлечения препарата необходимо использовать контейнер;
- почку и мочеточник нужно удалять единым блоком с резецированной стенкой мочевого пузыря в области устья;
- наличие большой инвазивной опухоли (Т3/Т4 и/или N+/М+) является противопоказанием к лапароскопической РНУ, поскольку она уступает по эффективности открытой РНУ [180, 181].
Лапароскопическая РНУ безопасна в опытных руках при соблюдении строгих принципов онкологии. Наблюдается тенденция к получению сопоставимых результатов после лапароскопической и открытой РНУ [179, 182–185] (УД: 3). Только в одном проспективном рандомизированном исследовании показано, что лапароскопическая РНУ не уступает открытой при неинвазивном переходно-клеточном раке ВМП [181] (УД: 2). За последние 30 лет онкологические результаты после РНУ значительно не изменились, несмотря на улучшение стадирования и хирургической техники [186] (УД: 3). Кроме того, можно использовать робот-ассистированный доступ. В недавно опубликованных исследованиях показаны сопоставимые онкологические результаты [187–189].
7.1.2.1.3. Удаление стенки мочевого пузыря
Резекция дистального отдела мочеточника и его устья необходима в связи с риском развития рецидива в этой зоне [159, 169, 190–192]. Описано несколько техник для упрощения резекции дистального отдела мочеточника, включая отрыв, экстирпацию, трансуретральную резекцию интрамурального отдела мочеточника и инвагинацию. Ни одна из этих методик не сопоставима по эффективности с полной резекцией устья мочеточника со стенкой мочевого пузыря [15, 190, 191] (УД: 3).
7.1.2.1.4. Лимфодиссекция
Использование шаблона для лимфодиссекции, вероятнее всего, в большей степени влияет на выживаемость, чем количество удаленных ЛУ [193]. Соблюдение шаблона и полноты лимфодиссекции позволяет улучшить канцероспецифическую выживаемость у пациентов с инвазивным раком и снизить риск местного рецидива [194]. Даже при отсутствии клинических [195] или морфологических признаков поражения ЛУ [196] лимфодиссекция способствует улучшению выживаемости.
Риск метастазов в ЛУ увеличивается вместе со стадией опухоли [130]. Лимфодиссекция не является необходимой при опухолях Та-Т1 вследствие низкого риска метастазов в ЛУ [197–200], однако, учитывая возможные неточности в предоперационном стадировании, лимфодиссекцию необходимо выполнять всем пациентам в соответствии с анатомическим шаблоном. В литературе описаны шаблоны для лимфодиссекции [194, 201, 202].
7.1.3. Периоперационная химиотерапия в качестве дополнения к радикальной нефруретерэктомии
7.1.3.1. Неоадъювантная химиотерапия
В ряде ретроспективных исследований, в которых оценивали роль неоадъювантной химиотерапии, получены перспективные результаты по снижению стадии и частоте полного ответа [203–207]. Не-
оадъювантная терапия позволяет снизить риск рецидива и смертность по сравнению с РНУ в режиме монотерапии [208–210]. К настоящему времени не опубликовано результатов рандомизированных исследований.
7.1.3.2. Адъювантная химиотерапия
В ретроспективных исследованиях получены противоречивые результаты по эффективности адъювантной химиотерапии [211–213]. В популяционном исследовании (n = 3253) показано увеличение общей выживаемости при переходно-клеточном раке стадии pT3/T4 и/или pN+ [214], хотя эти результаты не подтверждены в многоцентровом когортном исследовании у пациентов с РМП стадии pT2-T4 и/или N+ (n = 1544) [212].
Основным ограничением адъювантной химиотерапии при распространенном раке остается невозможность использовать полную дозу цисплатина после РНУ вследствие нарушения почечной функции [215, 216]. На конгрессах были представлены многообещающие результаты проспективного рандомизированного исследования II фазы, в котором оценивали преимущество адъювантной химиотерапии на основе препаратов платины при переходно-клеточном раке ВМП стадии pT2-4, N0-3M0. Ожидается публикация результатов данного исследования.
7.1.4. Адъювантная лучевая терапия после радикальной нефруретерэктомии
Адъювантная лучевая терапия снижает риск местного рецидива после РНУ. Данные литературы остаются противоречивыми и не позволяют сделать окончательные выводы [217–220]. Более того, необходимо оценить дополнительную пользу лучевой терапии при проведении химиотерапии [219].
7.1.5. Адъювантная внутрипузырная химиотерапия
Частота внутрипузырного рецидива после РНУ составляет 22–47% [116, 191]. В двух проспективных рандомизированных исследованиях [221, 222] и метаанализе [223] показано, что однократная внутрипузырная химиотерапия непосредственно после операции (митомицин C, пирарубицин, в течение 2–10 дней) снижает риск внутрипузырного рецидива в течение года (УД: 2). При подозрении на наличие экстравазации перед инстилляцией необходимо выполнить цистографию.
Несмотря на отсутствие прямого подтверждения эффективности внутрипузырной инстилляции химиопрепаратов после органосохраняющего лечения, однократное введение представляется эффективным (УД: 4). На рис. 7.1 и 7.2 представлен алгоритм лечения.
7.1.6. Резюме по данным литературы и рекомендации по лечению неметастатического рака верхних мочевыводящих путей высокого риска
| Резюме по данным литературы | УД |
|---|---|
|
Неполное удаление стенки мочевого пузыря в области устья мочеточника повышает риск внутрипузырного рецидива |
3 |
|
Лимфодиссекция повышает выживаемость при инвазивном переходно-клеточном раке ВМП |
3 |
|
Периоперационная химиотерапия повышает выживаемость |
3 |
|
Однократная внутрипузырная химиотерапия в послеоперационном периоде снижает риск внутрипузырного рецидива |
1 |
| Рекомендации | СР |
|---|---|
|
РНУ показана при неметастатическом переходно-клеточном раке ВМП высокого риска |
Сильная |
|
При нелокализованном переходно-клеточном раке ВМП показана открытая РНУ |
Слабая |
|
Необходимо полностью резецировать стенку мочевого пузыря в области устья мочеточника |
Сильная |
|
При переходно-клеточном раке ВМП высокого риска показана лимфодиссекция по анатомическим шаблонам |
Сильная |
|
При инвазивном переходно-клеточном раке ВМП показана периоперационная химиотерапия |
Слабая |
|
Послеоперационная внутрипузырная химиотерапия снижает риск внутрипузырного рецидива |
Сильная |
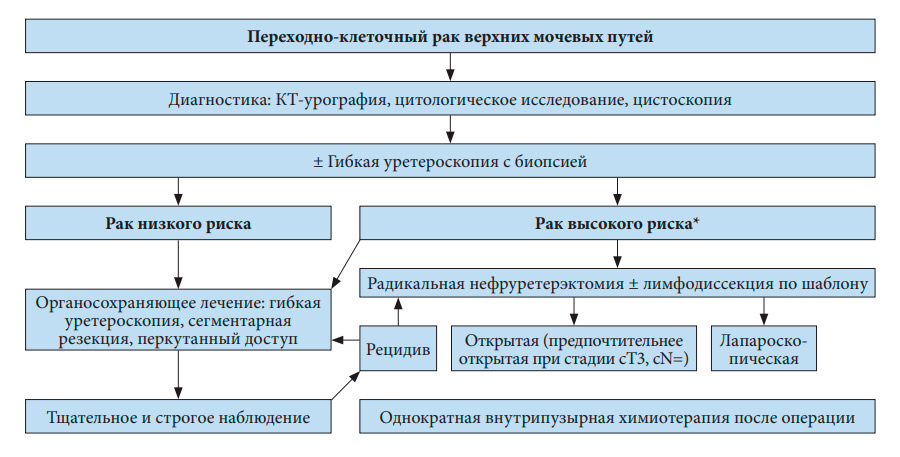
* У пациентов с единственной почкой можно рассмотреть более консервативный подход.
Рис. 7.1. Предлагаемый алгоритм лечения локализованного переходно-клеточного рака верхних мочевыводящих путей
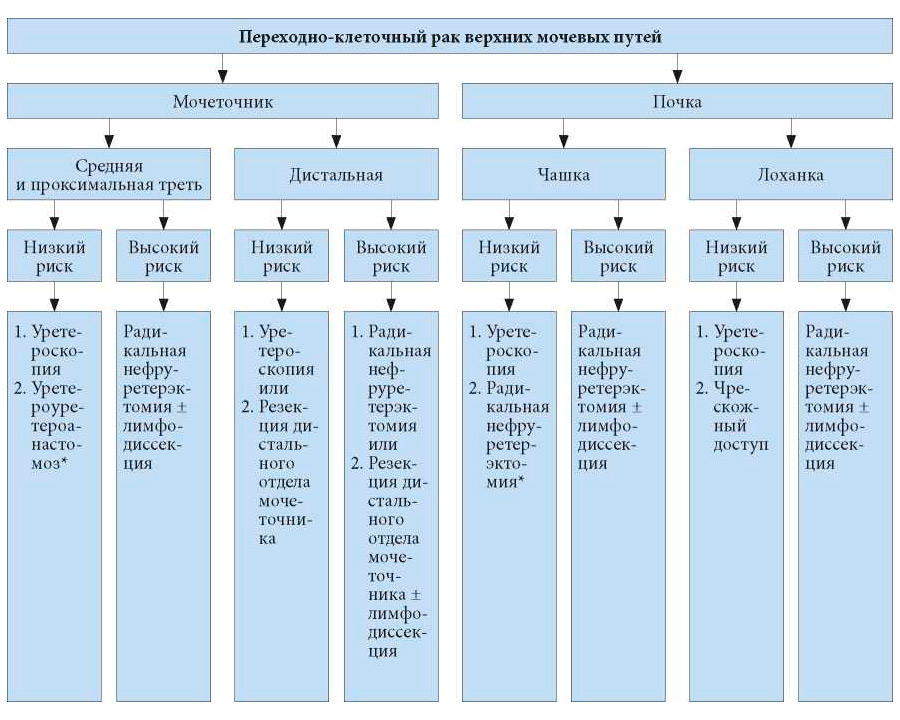
1. Первый вариант лечения
2. Второй вариант лечения
* В случае невозможности эндоскопического лечения.>
Рис. 7.2. Хирургическое лечение в зависимости от локализации и акторов риска
7.2. Метастатическая болезнь
7.2.1. Радикальная нефруретерэктомия
В ряде обсервационных исследований оценивали роль РНУ в лечении метастатического переходно-клеточного рака ВМП [224–227]. Несмотря на ограниченность данных, РНУ повышает канцероспецифическую [224, 226, 227] и общую выживаемость у отдельных пациентов, особенно при отсутствии противопоказаний к химиотерапии на основе цисплатина [225, 226]. Следует отметить, что эти преимущества могут относиться только к пациентам с одной локализацией метастазов [226]. Учитывая высокий риск неточностей в обсервационных исследованиях,
в которых оценивали РНУ при метастатическом раке, показания к хирургическому лечению должны быть только паллиативными, с целью контроля над симптомами [17, 106] (УД: 3). При частичном или полном ответе на индукционную химиотерапию можно обсудить с пациентом выполнение РНУ.
7.2.2. Метастазэктомия
В литературе отсутствуют данные по целесообразности метастазэктомии у пациентов с распространенным процессом. Результаты исследования, включавшего пациентов с раком ВМП и мочевого пузыря, свидетельствуют о безопасности и онкологической эффективности данного подхода у тщательно отобранных пациентов с ожидаемой продолжительностью жизни более 6 месяцев [228–230]. Это подтверждено в самом крупном и наиболее свежем исследовании, опубликованном на данный момент [231]. При отсутствии рандомизированных исследований следует определять тактику на индивидуальной основе и принимать решение об удалении метастазов (хирургическим путем или с использованием других методов) совместно с пациентом.
7.2.3. Системная химиотерапия
7.2.3.1. Первая линия терапии
Экстраполируя данные по РМП и результаты небольших, одноцентровых исследований по раку ВМП, комбинированная химиотерапия на основе препаратов платины (особенно цисплати-на) представляется эффективной в рамках первой линии терапии метастатического рака ВМП. В ретроспективном анализе трех рандомизированных исследований показано, что локализация первичной опухоли не оказывает влияния на выживаемость без прогрессирования или общую выживаемость у пациентов с местнораспространенным или метастатическим переходно-клеточ-
ным раком ВМП, которым проводится комбинированная химиотерапия на основе препаратов платины [232].
В литературе представлены результаты единичных исследований, в которых оценивали роль иммунотерапии в рамках первой линии терапии у пациентов с переходно-клеточным раком ВМП без противопоказаний к цисплатину. Прежде всего в исследовании II фазы без группы сравнения, включавшем 370 пациентов, показано, что у больных с переходно-клеточным раком ВМП (n = 69/19%) показатель объективного ответа составил 22% [233]. В общей когорте экспрессия PD-L1 10% была связана с более высокой частотой ответа на пембролизумаб, кото-
рый имел относительно приемлемую токсичность. Далее, в исследовании II фазы атезолизумаба без группы сравнения, включавшем 119 пациентов, получавших атезолизумаб, показано, что у больных с переходно-клеточным раком ВМП с противопоказаниями к цисплатину (n = 33, 27,7%) показатель объективного ответа составил 39% [234]. Медиана общей выживаемости во всей когорте составила 15,9 месяца, а токсичность была относительно приемлемой. К настоящему времени не опубликовано других данных по первой линии терапии, но в ряде исследо-
ваний III фазы оценивают пембролизумаб (NCT02853305 [235]), атезолизумаб (NCT028076[236]) и дурвалумаб (NCT02516241 [237]) в режиме монотерапии и комбинированную иммунотерапию ниволумабом (NCT03036098 [238]), дурвалумабом (NCT02516241 [237]) или пембролизумабом (NCT02178722 [239]) у пациентов с метастатическим переходно-клеточным раком, включая рак ВМП.
7.2.3.2. Вторая линия терапии
Аналогично РМП выбор терапии второй линии метастатического переходно-клеточного рака ВМП остается затруднительным. В дополнительном анализе подгруппы больных метастатическим/местнораспространенным переходно-клеточным раком ВМП показано, что винфлунин обладает сопоставимой эффективностью, как и у пациентов с прогрессированием метастатического РМП после химиотерапии на основе цисплатина [240].
Более важно, что в рандомизированном исследовании III фазы, включавшем 542 пациента с распространенным переходно-клеточным раком, ранее получавших химиотерапию на основе препаратов платины, показано, что пембролизумаб снижает риск летального исхода у пациентов с переходно-клеточным раком ВМП почти на 50% (n = 75, 13,8%), хотя различие имело пограничное значение [241]. В общей когорте частота объективного ответа составила 21,1%, а медиана общей выживаемости – 10,3 месяца. Примечательно, что, хотя не проводилось анализа подгрупп для пациентов с переходно-клеточным раком ВМП (n = 65/21%), в исследовании II фазы без группы сравнения показана длительная активность атезолизумаба, связанная с экспрессией PD-L1 на иммунных клетках у больных метастатическим переходно-клеточным раком [242]. У пациентов с гиперэкспрессией PD-L1 частота объективного ответа составила 26% по сравнению с 15% во всей популяции. Однако в рандомизированном исследовании III фазы не показано увеличения общей выживаемости по сравнению с химиотерапией у пациентов с гиперэкспрессией PD-L1, включая 51 больного переходно-клеточным раком ВМП (21,8%), несмотря на более приемлемый профиль безопасности [243].Частота объективного ответа у других препаратов для иммунотерапии, включая ниволумаб [244], авелумаб [245, 246] и дурвалумаб [247], в общей когорте больных метастатическим переходно-клеточным раком, резистентным к препаратам платины, варьирует от 17,8% [247] до 19,6% [244], а медиана общей выживаемости – от 7,7 до 18,2 месяца. Эти результаты получены только в исследованиях I или II фазы без группы сравнения, и число пациентов с раком ВМП было указано только в исследовании авелумаба (n = 7/15,9%) [246] без анализа подгрупп в зависимости от первичной локализации опухоли.
Комбинированная иммунотерапия ниволумабом и ипилимумабом имеет выраженную противоопухолевую активность. В многоцентровом исследовании I/II фазы, включавшем 78 пациентов с метастатическим раком ВМП и прогрессированием после химиотерапии на основе препаратов платины, частота объективного ответа составила 38% [248]. Хотя в это исследование вошли пациенты с переходно-клеточным раком ВМП, авторы не провели анализ подгрупп. Другие комбинации иммунотерапии могут быть эффективными в рамках второй линии терапии, но к настоящему времени не получено убедительных данных [249].
7.2.4. Резюме по данным литературы и рекомендации по лечению метастатического переходно-клеточного рака ВМП
| Резюме по данным литературы | УД |
|---|---|
|
РНУ у отдельных пациентов с метастатическим раком позволяет улучшить качество жизни и онкологические результаты |
3 |
|
Комбинированная химиотерапия на основе цисплатина позволяет повысить медиану выживаемости |
2 |
|
Монохимиотерапия и комбинированная химиотерапия на основе карбоплатина уступают по эффективности комбинированной химиотерапии на основе цисплатина в отношении частоты полного ответа и выживаемости |
3 |
|
Комбинированную химиотерапию без препаратов платины не сравнивали со стандартной химиотерапией у пациентов с или без противопоказаний к комбинированной химиотерапии на основе цисплатина |
4 |
|
По результатам исследования III фазы, ингибитор PD-1 пембролизумаб одобрен к применению у пациентов с прогрессированием рака во время или после комбинированной химиотерапии на основе препаратов платины |
1b |
|
По результатам исследования II фазы, ингибитор PD-L1 атезолизумаб одобрен к применению у пациентов с прогрессированием рака во время или после комбинированной химиотерапии на основе препаратов платины |
2a |
|
По результатам исследования II фазы, ингибитор PD-1 ниволумаб одобрен к применению у пациентов с прогрессированием рака во время или после комбинированной химиотерапии на основе препаратов платины |
2a |
|
По результатам исследования III фазы, ингибитор PD-1 пембролизумаб одобрен к применению у пациентов с распространенным или метастатическим переходно-клеточным раком с противопоказаниями к первой линии комбинированной химиотерапии на основе препаратов платины, однако его можно использовать только при наличии экспрессии PD-L1 |
2a |
|
По результатам исследования III фазы, ингибитор PD-L1 атезолизумаб одобрен к применению у пациентов с распространенным или метастатическим переходно-клеточным раком с противопоказаниями к первой линии комбинированной химиотерапии на основе препаратов платины, однако его можно использовать только при наличии экспрессии PD-L1 |
2a |
| Рекомендации | СРh |
|---|---|
|
РНУ показана в качестве паллиативного лечения пациентам с симптоматическим операбельным местнораспространенным раком ВМП |
Слабая |
|
Препараты первой линии для пациентов без противопоказаний к цисплатину |
|
|
Химиотерапия на основе препаратов платины включает схемы GC, MVAC, предпочтительно с Г-КСФ, высокодозный режим MVAC с Г-КСФ или PCG |
Сильная |
|
Карбоплатин и комбинированная химиотерапия без препаратов платины не показаны |
Сильная |
|
Препараты первой линии для пациентов с противопоказаниями к цисплатину |
|
|
Ингибиторы иммунных контрольных точек (пембролизумаб или атезолизумаб) необходимо назначать в зависимости от экспрессии PD-L1 |
Слабая |
|
При отсутствии экспрессии PD-L1 показана комбинированная химиотерапия на основе карбоплатина |
Сильная |
|
Препараты второй линии |
|
|
Ингибитор иммунных контрольных точек (пембролизумаб) показан пациентам с прогрессированием метастатического рака во время или после комбинированной химиотерапии на основе препаратов платины |
Сильная |
|
Ингибитор иммунных контрольных точек (атезолизумаб) показан пациентам с прогрессированием метастатического рака во время или после комбинированной химиотерапии на основе препаратов платины |
Сильная |
|
Винфлунин показан только пациентам с метастатическим раком в качестве препарата второй линии, если нельзя провести иммунотерапию или комбинированную химиотерапию. Кроме того, винфлунин можно использовать в рамках третьей или последующих линий терапии |
Сильная |
8. Наблюдение
Риск рецидива рака ВМП и смерти изменяется по мере наблюдения после операции и, вероятно, со временем становится ниже [250]. Для выявления метахронного РМП (вероятность со временем повышается [251]), местного рецидива и отдаленных метастазов требуется самое строгое наблюдение (раздел 8.1). В разделе 8.1 представлены резюме по данным литературы и рекомендации по наблюдению пациентов.
Режим наблюдения включает цистоскопию и цитологическое исследование мочи в течение > 5 лет [12, 14, 15, 161]. Развитие рецидива в мочевом пузыре не следует рассматривать как появление от даленных метастазов. В случае выполнения органосохраняющего лечения требуется тщательный мониторинг состояния ипсилатеральных ВМП ввиду высокого риска развития рецидива [165, 252, 253]. Несмотря на постоянное совершенствование эндоурологической техники, наблюдение за пациентами, пролеченными консервативно, остается сложной задачей и требует повторного выполнения малоинвазивных манипуляций. Как и при РМП, после органосохраняющего лечения можно проводить повторный «second-look» осмотр, но это не является рутинной практикой [2, 166].
8.1. Резюме по данным литературы и рекомендации по наблюдению переходно-клеточного рака верхних мочевыводящих путей
| Резюме по данным литературы | УД |
|---|---|
|
После органосохраняющего лечения требуется более частое и строгое наблюдение, чем после РНУ |
3 |
| Рекомендации | СР |
|---|---|
|
После РНУ: |
|
|
Опухоли низкого риска |
|
|
Цистоскопия через 3 месяца, далее через 9 месяцев, далее ежегодно в течение 5 лет. |
Слабая |
|
Опухоли высокого риска |
|
|
Цистоскопия и цитологическое исследование мочи через 3 месяца. При отрицательном результате необходимо повторять цистоскопию и цитологическое исследование мочи каждые 3 месяца в течение 2 лет, затем каждые 6 месяцев в течение 5 лет, далее ежегодно |
Слабая |
|
КТ-урографию и КТ органов грудной клетки необходимо проводить каждые 6 месяцев в течение 2 лет, далее ежегодно |
Слабая |
|
После органосохраняющего лечения: |
|
|
Опухоли низкого риска |
|
|
Цистоскопия и КТ-урография через 3 и 6 месяцев, далее ежегодно в течение 5 лет. |
Слабая |
|
Уретероскопия через 3 месяца |
Слабая |
|
Опухоли высокого риска |
|
|
Цистоскопия, цитологическое исследование мочи, КТ-урография и КТ органов грудной клетки через 3 и 6 месяцев, далее ежегодно. |
Слабая |
|
Уретероскопия и цитологическое исследование in situ через 3 и 6 месяцев. |
Слабая |
9. Литература (представлена в конце издания)
10. Конфликт интересов
Все члены группы по составлению клинических рекомендаций по опухолям ВМП предоставили открытый отчет по всем взаимоотношениям, которые они имеют и которые могут быть восприняты как причина конфликта интересов. Эта информация доступна на сайте Европейской ассоциации урологов: http://uroweb.org/guideline/upper-urinary-tract-urothelial-cell-carcinoma/. Данные рекомендации были созданы при финансовой поддержке ЕАУ. При этом не использовались внешние источники финансирования и поддержки. ЕАУ – некоммерческая организация, финансовые издержки которой ограничиваются административными расходами, а также оплатой поездок и встреч. Авторам рекомендаций ЕАУ не предоставляла гонораров или какой-либо другой компенсации.
11. Информация по цитированию
Формат, по которому необходимо цитировать рекомендации ЕАУ, варьирует в зависимости от типа журнала. Соответственно может отличаться количество авторов или, например, данные об издателе, местоположении или номере ISBN.
Ссылка на полную версию рекомендаций оформляется следующим образом:
EAU Guidelines. Edn. presented at the EAU Annual Congress, Amsterdam, the Netherlands, 2020. ISBN 978-94-92671-07-3.
Если требуется издатель и/или местоположение:
EAU Guidelines Office, Arnhem, The Netherlands. http://uroweb.org/guidelines/compilations-of-all-guidelines/
Ссылки на отдельные рекомендации оформляются следующим образом:
Имена авторов. Название источника. Тип публикации. ISBN. Издатель и его местоположение, год.
Клинические рекомендации по неинвазивному раку мочевого пузыря (Ta, T1 и карцинома in situ)
M. Babjuk (председатель), M. Burger (вице-председатель), E. Compérat,
P. Gontero, A.H. Mostafid, J. Palou, B.W.G. van Rhijn, M. Rouprêt,
S.F. Shariat, R. Sylvester, R. Zigeuner
Помощники в составлении рекомендаций: O. Capoun, D. Cohen,
J.L. Dominguez Escrig, V. Hernández, B. Peyronnet, T. Seisen, V. Soukup
Перевод: К.А. Ширанов
Научное редактирование:
А.Д. Каприн, Б.Я. Алексеев, А.С. Калпинский
© Европейская ассоциация урологов, 2020
СОДЕРЖАНИЕ
- 1. Введение
- 1.1. Цели и задачи
- 1.2. Состав рабочей группы
- 1.3. Доступные публикации
- 1.4. История публикаций и резюме по изменениям
- 1.4.1. История публикаций
- 1.4.2. Резюме по изменениям
- 2. Методы
- 2.1. Поиск данных
- 2.2. Рецензирование
- 2.3. Будущие цели
- 3. Эпидемиология, этиология и патогенез
- 3.1. Эпидемиология
- 3.2. Этиология
- 3.3. Гистологические типы
- 3.4. Резюме по данным литературы по эпидемиологии, этиологии и патогенезу
- 4. Стадирование и классификация
- 4.1. Определение неинвазивного рака мочевого пузыря
- 4.2. Классификация TNM
- 4.3. Подразделение стадии T1
- 4.4. Гистологическая градация неинвазивного переходно-клеточного рака мочевого пузыря
- 4.5. Карцинома in situ и ее классификация
- 4.6. Вариабельность определения стадии и степени злокачественности между одним и разными исследователями
- 4.7. Другие перспективные морфологические параметры
- 4.8. Молекулярная классификация
- 4.9. Резюме по данным литературы и рекомендации по классификации рака мочевого пузыря
- 5. Диагностика
- 5.1. Анамнез пациента
- 5.2. Признаки и симптомы
- 5.3. Физикальное исследование
- 5.4. Методы визуализации
- 5.4.1. Компьютерная томография и экскреторная урография
- 5.4.2. Ультразвуковое исследование
- 5.4.3. Мультипараметрическая магнитно-резонансная томография
- 5.5. Цитологическое исследование мочи
- 5.6. Исследование молекулярных маркеров в моче
- 5.7. Практическое применение цитологического исследования мочи и маркеров
- 5.7.1. Массовое обследование популяции, имеющей риск развития РМП
- 5.7.2. Обследование пациентов с гематурией или другими симптомами, позволяющими заподозрить наличие РМП (первичное выявление)
- 5.7.3. Наблюдение неинвазивного рака мочевого пузыря
- 5.7.3.1. Наблюдение пациентов с неинвазивным раком мочевого пузыря высокого риска
- 5.7.3.2. Наблюдение пациентов с неинвазивным раком мочевого пузыря низкого и промежуточного риска
- 5.8. Цистоскопия
- 5.9. Резюме по данным литературы и рекомендации по первичной диагностике неинвазивного рака мочевого пузыря
- 5.10. Трансуретральная резекция опухолей мочевого пузыря стадии Ta, T1
- 5.10.1. Стратегия операции
- 5.10.2. Хирургические и технические аспекты резекции опухоли
- 5.10.2.1. Хирургическая стратегия резекции (резекция по частям, en-bloc резекция)
- 5.10.2.2. Оценка качества резекции
- 5.10.2.3. Монополярная и биполярная резекция
- 5.10.2.4. Амбулаторная фульгурация и лазерная вапоризация
- 5.10.2.5. Резекция небольших папиллярных опухолей мочевого пузыря во время трансуретральной резекции предстательной железы
- 5.10.3. Биопсия мочевого пузыря
- 5.10.4. Биопсия простатического отдела уретры
- 5.11. Новые методы визуализации опухоли
- 5.11.1. Фотодинамическая диагностика (флуоресцентная цистоскопия)
- 5.11.2. Узкополосная визуализация
- 5.11.3. Дополнительные технологии
- 5.12. Повторная резекция
- 5.12.1. Выявление резидуальных образований и повышение стадии опухоли
- 5.12.2. Влияние повторной резекции на результаты лечения
- 5.12.3. Время выполнения повторной резекции
- 5.12.4. Запись результатов
- 5.13. Морфологическое заключение
- 5.14. Резюме по данным литературы и рекомендации по ТУР мочевого пузыря и протоколу патоморфологического исследования
- 6. Прогнозирование рецидива и прогрессирования рака мочевого пузыря
- 6.1. Опухоли стадии Ta, T1
- 6.2. Карцинома in situ
- 6.3. Стратификация пациентов по группам риска
- 6.4. Подгруппа опухолей самого высокого риска
- 6.5. Резюме по данным литературы и рекомендации по стратификации неинвазивного рака мочевого пузыря
- 7. Лечение
- 7.1. Рекомендации по прекращению курения
- 7.2. Адъювантная терапия
- 7.2.1. Внутрипузырная химиотерапия
- 7.2.1.1. Однократная немедленная послеоперационная внутрипузырная химиотерапия
- 7.2.1.2. Дополнительная адъювантная внутрипузырная химиотерапия
- 7.2.1.3. Оптимизация эффективности внутрипузырной химиотерапии
- 7.2.1.4. Резюме по данным литературы – внутрипузырная химиотерапия
- 7.2.2. Внутрипузырная БЦЖ-иммунотерапия
- 7.2.2.1. Эффективность БЦЖ-терапии
- 7.2.2.2. Штаммы БЦЖ
- 7.2.2.3. Токсичность БЦЖ-терапии
- 7.2.2.4. Оптимальный режим БЦЖ-терапии
- 7.2.2.5. Оптимальная доза БЦЖ-терапии
- 7.2.2.6. Показания к БЦЖ-терапии
- 7.2.2.7. Резюме по данным литературы – БЦЖ-терапия
- 7.2.3. Комбинированная терапия
- 7.2.3.1. Комбинация внутрипузырной БЦЖ-терапии и химиотерапии по сравнению с БЦЖ-терапией в режиме монотерапии
- 7.2.3.2. Комбинированная терапия с применением интерферона
- 7.2.4. Особенности лечения карциномы in situ
- 7.2.4.1. Тактика лечения
- 7.2.4.2. Когортные исследования внутрипузырной БЦЖ-терапии или химиотерапии
- 7.2.4.3. Проспективные рандомизированные исследования внутрипузырной БЦЖ-терапии или химиотерапии
- 7.2.4.4. Лечение внепузырной карциномы in situ
- 7.2.4.5. Резюме по данным литературы – лечение карциномы in situ
- 7.3. Лечение при неэффективности внутрипузырной терапии
- 7.3.1. Неэффективность внутрипузырной терапии
- 7.3.2. Рецидивы и неэффективность внутрипузырной БЦЖ-терапии
- 7.3.3. Лечение при неэффективности БЦЖ-терапии и рецидива после БЦЖ-терапии
- 7.3.4. Резюме по данным литературы – лечение при внутрипузырном рецидиве
- 7.4. Радикальная цистэктомия при неинвазивном раке мочевого пузыря
- 7.5. Рекомендации по адъювантной терапии опухолей стадии Ta, T1 и карциномы in situ
- 7.6. Рекомендации по лечению опухолей стадии Ta, T1 и карциномы in situ в зависимости от группы риска
- 7.7. Рекомендации по лечению больных с неэффективностью БЦЖ-терапии
- 7.2.1. Внутрипузырная химиотерапия
- 8. Наблюдение за пациентами с неинвазивным раком мочевого пузыря
- 8.1. Резюме по данным литературы и рекомендации по наблюдению пациентов с неинвазивным раком мочевого пузыря
- 9. Литература (представлена в конце издания)
- 10. Конфликт интересов
- 11. Информация по цитированию
1. Введение
1.1. Цели и задачи
Данный обзор представляет собой обновленные рекомендации Европейской ассоциации урологов (ЕАУ) по неинвазивному раку мочевого пузыря (НИРМП): опухолям стадии Ta, T1 и карциноме in situ. Если не указано иное, вся информация относится к переходно-клеточному раку. Цель
рекомендаций заключается в том, чтобы дать практические рекомендации по клиническому лечению НИРМП, уделяя особое внимание клиническим проявлениям и тактике ведения.
Кроме того, опубликованы отдельные документы ЕАУ с рекомендациями по опухолям верхних мочевыводящих путей [1], инвазивному раку мочевого пузыря (ИРМП) [2] и первичному раку уретры [3]. Необходимо подчеркнуть, что клинические рекомендации включают наиболее качественные данные, доступные в настоящее время экспертам. Однако следование рекомендациям не всегда приведет к оптимальному результату. Клинические рекомендации никогда не заменят клинический опыт при определении тактики лечения конкретного пациента, а скорее помогут направить ее с учетом персональных данных и предпочтений/конкретной ситуации больного. Рекомендации не являются обязательными для соблюдения и не рассматриваются как юридический стандарт оказания помощи.
1.2. Состав рабочей группы
Рабочая группа ЕАУ по НИРМП состоит из международной многопрофильной команды экспертов, включая уролога, онкоуролога, морфолога и статистика. Члены рабочей группы выбраны на основании их опыта, чтобы представлять специалистов, занимающихся лечением пациентов с подозрением на рак мочевого пузыря (РМП). Все эксперты, которые принимали участие в создании документа, направили заявление о возможном конфликте интересов, которое можно посмотреть на сайте ЕАУ: https://uroweb.org/guideline/non-muscle-invasive-bladder-cancer/.
1.3. Доступные публикации
Доступны краткие рекомендации как в печатном виде, так и в различных версиях для мобильных устройств на базе iOS и Android, в которых представлены основные данные из рекомендаций по НИРМП. Это сокращенные версии, которые требуют обращения к полному тексту рекомендаций. Опубликован ряд научных статей, последняя из которых датируется 2016 г. [4], а также несколько переводов всех версий рекомендаций. Все документы доступны на сайте ЕАУ: https://uroweb.org/guideline/non-muscle-invasive-bladder-cancer/.
1.4. История публикаций и резюме по изменениям
1.4.1. История публикаций
Первые рекомендации ЕАУ по раку мочевого пузыря были опубликованы в 2000 г. Настоящее печатное издание представляет собой ограниченное обновление рекомендаций 2019 г.
1.4.2. Резюме по изменениям
Во все разделы включены дополнительные данные. В следующих разделах сделаны наибольшие изменения:
- 4.7 «Редкие гистологические варианты и лимфососудистая инвазия»: раздел расширен,
включена дополнительная информация по редким гистологическим вариантам; - 7.3 «Лечение при неэффективности внутрипузырной терапии»: раздел значительно расширен,
пересмотрены рис. 7.2, табл. 7.2 «Категории неэффективности внутрипузырной БЦЖ-терапии»
и раздел 7.7 «Рекомендации по лечению больных с неэффективностью БЦЖ-терапии».
В следующих разделах изменены рекомендации:
7.5. Рекомендации по адъювантной терапии опухолей стадии Ta, T1 и карциномы in situ
|
Рекомендации |
СР |
|---|---|
|
При отсутствии ответа на БЦЖ-терапию показана радикальная цистэктомия (см. раздел 7.7) |
Сильная |
|
При отсутствии ответа на БЦЖ-терапию и противопоказаниях к радикальной цистэктомии (вследствие сопутствующих заболеваний) рекомендуется стратегия сохранения мочевого пузыря (внутрипузырная химиотерапия, внутрипузырная химиотерапия с микроволновой гипертермией, внутрипузырная химиотерапия с использованием EDMA, внутрипузырная или системная иммунотерапия, предпочтительно в рамках клинических исследований) |
Слабая |
7.7. Рекомендации по лечению больных с неэффективностью БЦЖ-терапии
|
Категория |
Рекомендации по лечению |
СР |
|---|---|---|
|
Отсутствие ответа на БЦЖ-терапию |
1. Радикальная цистэктомия |
Сильная |
|
2. Включение в клинические исследования по оценке новых стратегий лечения |
Слабая |
|
|
3. Стратегии сохранения мочевого пузыря у пациентов, которые не подходят или отказываются от цистэктомии |
Слабая |
|
|
Рецидив опухоли стадии T1-Ta/высокой степени злокачественности в срок более 6 месяцев или карцинома in situ в срок более года после завершения БЦЖ-терапии |
1. Радикальная цистэктомия или повторный курс БЦЖ-терапии в зависимости от индивидуальной ситуации |
Сильная |
|
2. Стратегии сохранения мочевого пузыря |
Слабая |
|
|
Рецидив после БЦЖ-терапии низкой степени злокачественности после лечения первичной опухоли промежуточного риска |
1. Повторный курс БЦЖ-терапии или химиотерапии |
Слабая |
|
2. Радикальная цистэктомия |
Слабая |
2. Методы
2.1. Поиск данных
В клинических рекомендациях 2019 г. по НИРМП посредством структурированного литературного поиска найдены, сопоставлены и оценены новые и клинически значимые данные.
Рабочая группа провела обширный поиск литературы, охватывающий все аспекты рекомендаций по НИРМП. Из полученных статей исключены базовые исследования, серии случаев, отчеты и комментарии редакторов. Включены только исследования взрослых пациентов, результаты которых опубликованы на английском языке. Кроме того, поиск был ограничен с 8 июня 2018 г. по 16 мая 2019 г. Поиск проводился в базе данных Pubmed, Ovid, EMBASE и центральном реестре и базе Кокрейновских систематических обзоров. После дедубликации найдены и проанализированы 1124 статьи.
В настоящие рекомендации всего включена 31 новая публикация. Поисковая стратегия представлена по адресу: https://uroweb.org/guideline/non-muscle-invasive-bladder-cancer/?type=appendices-publications.
В разделах 3–6 («Эпидемиология, этиология и патогенез», «Стадирование и классификация», «Диагностика и прогноз») литература оценивалась по уровню доказательности (УД), а рекомендации градировали по степени (СР) согласно системе, модифицированной из классификации Оксфордского центра медицинских исследований, основанной на доказательствах [5]. В разделах 7 и 8 («Лечение» и «Наблюдение») использовали систему, модифицированную из классификации Оксфордского центра медицинских исследований, основанной на доказательствах, 2009 г. [5].
Для каждой рекомендации в онлайн-режиме заполняется форма для определения силы, с учетом ряда основных элементов, на основании модифицированной методологии GRADE [6, 7]. Сила рекомендаций определяется с учетом следующих основных элементов:
- общее качество данных в поддержку рекомендаций; ссылки, используемые в этом тексте, градируются по степени согласно системе, модифицированной из классификации Оксфордского центра медицинских исследований, основанной на доказательствах [5];
- выраженность эффекта (индивидуальный или комбинированный эффект);
- убедительность результатов (точность, согласованность, неоднородность и другие статистические или связанные с исследованиями факторы);
- баланс между желательными и нежелательными исходами;
- влияние ценностей и предпочтений пациента на вмешательство;
- точность этих ценностей и предпочтений пациента.
Эти основные элементы стали основой, которую рабочая группа использует для определения силы каждой рекомендации. Она в свою очередь описана терминами «сильная» или «слабая» [7]. Сила каждой рекомендации определяется балансом между желательными и нежелательными последствиями альтернативных стратегий, качеством данных (включая точность критериев) и природой и вариабельностью ценностей и предпочтений пациентов. С целью консультирования таблицы опубликованы онлайн.
Дополнительную информацию по методологии можно найти в общем разделе «Методология» настоящего печатного издания или в онлайн-версии на сайте ЕАУ: http://www.uroweb.org/guideline/.
По указанному адресу также можно просмотреть список ассоциаций, которые оказали поддержку в составлении рекомендаций ЕАУ.
2.2. Рецензирование
Перед публикацией проведено рецензирование изменений, сделанных по результатам систематических обзоров. Кроме того, в 2019 г. выполнено рецензирование всех разделов рекомендаций.
2.3. Будущие цели
В обновления рекомендаций 2020 г. будут включены результаты продолжающихся и новых систематических обзоров. Они проводятся по стандартной методологии Кохрана для систематических обзоров; http://www.cochranelibrary.com/about/about-cochrane-systematic-reviews.html:.
В настоящее время проводятся следующие систематические обзоры:
• прогностическое исследование классификации ВОЗ 1973 и 2004 гг. и шкалы риска
EORTC 2006 г. по индивидуальным данным пациентов при первичном РМП стадии Ta-T1;
3. Эпидемиология, этиология и патогенез
3.1. Эпидемиология
РМП занимает 7-е место по распространенности у мужчин и 11-е – у лиц обоих полов [8]. По всему миру стандартизированная по возрасту частота заболевания составляет 9,0 случая на 100 000 для мужчин и 2,2 случая на 100 000 для женщин [8]. В Европейском союзе (ЕС) стандартизированные по возрасту показатели встречаемости составляют 19,1 случая на 100 000 для мужчин и 4,0 случая на 100 000 для женщин [8]. В Европе самые высокие показатели стандартизированной по возрасту встречаемости наблюдаются в Бельгии (31 у мужчин, 6,2 у женщин), а самые низкие – в Финляндии (18,1 для мужчин, 4,3 для женщин) [8].
В 2012 г. стандартизированная по возрасту смертность во всем мире от РМП на 100 000 человек составила 3,2 случая у мужчин и 0,9 у женщин [8]. Показатели встречаемости и смертности широко варьируют между странами вследствие различий в факторах риска, особенностей выявления и диагностики и доступности лечения. При этом вариации отчасти связаны с различной методологией и качеством сбора данных [9]. В ряде реестров отмечается снижение встречаемости и смертности от РМП, что, вероятно, отражает уменьшение воздействия причинных факторов [10].
Примерно у 75% пациентов РМП при диагностике ограничен слизистой (стадия Та, карцинома in situ) или подслизистой оболочкой (стадия Т1); у больных молодого возраста (< 40 лет) этот показатель еще выше [11]. Эти категории имеет высокую распространенность вследствие длительной выживаемости во многих случаях и более низкой канцероспецифической смертности по сравнению с ИРМП [8, 9].
3.2. Этиология
Курение табака – важнейший фактор риска РМП, на который приходится почти 50% случаев [9, 10, 12, 13] (УД: 3). Табачный дым содержит ароматические амины и полициклические ароматические углеводороды, которые выделяются из организма через почки.
Производственное воздействие ароматических аминов, полициклических ароматических углеводородов и хлорированных углеводородов на рабочем месте – второй по важности фактор риска РМП, на который приходится до 10% всех случаев. Такой тип воздействия имеет место в основном на промышленных предприятиях, выпускающих и использующих краски, красители, металл и нефтепродукты [9, 10, 14, 15]. В развитых промышленных странах этот риск снижается за счет рекомендаций по технике безопасности на рабочем месте, поэтому у рабочих, занятых в химической промышленности, РМП теперь встречается не чаще, чем среди населения в целом [9, 14, 15].
Несмотря на то что отягощенный семейный анамнез не оказывает значимого влияния [16] и к настоящему времени не выявлено специфических генетических вариаций при РМП, генетическая предрасположенность оказывает влияние на частоту возникновения РМП посредством повышения чувствительности к другим факторам риска [9, 17–21]. Данный факт может обусловливать семейные случаи РМП с повышением риска у родственников первой и второй линии (отношение риска: 1⁄4 1,69, 95% доверительный интервал (ДИ): 1⁄4, 1,47–1,95, p < 0,001) [22].
Хотя важность количества выпиваемой жидкости до конца не ясна, хлорирование питьевой воды и последующий уровень тригалогенметанов имеют потенциально канцерогенный эффект, при этом наличие примеси мышьяка в питьевой воде повышает риск [9, 23] (УД: 3). Прием мышьяка и курение имеют комбинированный эффект [24]. Связь между окрашиванием волос и риском остается неясной; предполагается, что риск повышен у пациентов с медленным ацетилированием NAT2 [9].
Особенности питания оказывают незначительное влияние. Флавоноиды и средиземноморская диета, характеризующаяся высоким потреблением овощей и ненасыщенных жирных кислот (оливкового масла) и умеренным потреблением белка, имеет протективный эффект в отношении риска РМП (отношение риска 0,85 (95% ДИ 0,77–0,93)) [25–30]. Воздействие ионизирующей радиации повышает риск РМП. Циклофосфамид и пиоглитазон имеют слабую связь с развитием РМП [9, 23, 31] (УД: 3). Влияние метаболических факторов (индекса массы тела, артериального давления, уровня глюкозы, холестерина и триглицеридов крови) до конца не изучено [32]. Кроме того, этиологическую роль может играть шистосомоз, хронический эндемический цистит, связанный с повторным инфицированием паразитом из класса трематод [9] (УД: 3).
3.3. Гистологические типы
В настоящих рекомендациях представлена информация только по переходно-клеточному раку, если нет других указаний.
3.4. Резюме по данным литературы по эпидемиологии, этиологии и патогенезу
| Резюме по данным литературы | УД |
|---|---|
|
Во всем мире РМП занимает 11-е место среди наиболее часто диагностированных злокачественных опухолей. |
2a |
|
Описан ряд факторов, связанных с риском развития РМП. |
3 |
4. Стадирование и классификация
4.1. Определение неинвазивного рака мочевого пузыря
Папиллярная опухоль, ограниченная слизистой и подслизистой оболочкой, относится к стадииТа и T1 соответственно по классификации TNM [33]. Плоские, ограниченные слизистой оболочкой опухоли высокой степени злокачественности классифицируют как карциному in situ (Tis). При этих опухолях можно проводить трансуретральную резекцию (ТУР) и/или внутрипузырные инстилляции, и поэтому они объединены под общим названием НИРМП с точки зрения лечения. Термин «неинвазивный рак мочевого пузыря» описывает целую группу опухолей, и во всех случаях необходимо указывать стадию T, степень дифференцировки и другие характеристики опухоли (см. разделы 4.5, 4.7 и сайт International Collaboration on Cancer Reporting website: http://www.iccr-cancer.org/datasets/ published-datasets/urinary-male-genital/carcinoma-of-the-bladder-cystectomy-cystoprostatec). Термин «поверхностный рак мочевого пузыря» больше не употребляется, поскольку он некорректен.
4.2. Классификация TNM
Принятая в 2009 г. Международным противораковым союзом (UICC) классификация TNM была пересмотрена в 2017 г. (8-е издание), однако изменения не коснулись опухолей мочевого пузыря (табл. 4.1) [33].
Таблица 4.1. Классификация рака мочевого пузыря, TNM, 2017
T - первичная опухоль
ТХ - первичная опухоль не может быть оценена
Т0 - нет данных о первичной опухоли
Ta - неинвазивная папиллярная карцинома
Tis - карцинома in situ: «плоская опухоль»
T1 - опухоль распространяется на субэпителиальную соединительную ткань
T2 - опухоль распространяется в мышечный слой
T2a - опухолевая инвазия в поверхностную мышечную ткань (внутренняя половина)
T2b - опухолевая инвазия глубокого мышечного слоя (наружная половина)
T3 - опухоль распространяется в околопузырную жировую клетчатку
T3a - микроскопическая инвазия
T3b - макроскопическая инвазия (образование за пределами мочевого пузыря)
T4 - опухолевая инвазия в одну из следующих структур: предстательная железа, матка, влагалище, стенка таза, брюшная стенка
T4a - опухолевая инвазия в предстательную железу, матку или влагалище
T4b - опухолевая инвазия в стенку таза или брюшную стенку
N - лимфатические узлы
NX - регионарные лимфатические узлы не могут быть оценены
N0 - нет метастазов в регионарных лимфатических узлах
N1 - метастазы в единичном лимфоузле в малом тазу (гипогастральном, запирательном, наружном подвздошном или предкрестцовом)
N2 - метастазы в нескольких лимфатических узлах в малом тазу (гипогастральных, запирательных, наружных подвздошных или предкрестцовых)
N3 - метастазы в общем подвздошном лимфатическом узле (узлах)
М - отдаленные метастазы
МХ - отдаленные метастазы не могут быть оценены
М0 - нет отдаленных метастазов
М1а - имеются метастазы в нерегионарных лимфоузлах
М1Ь - имеются метастазы в других локализациях
4.3. Подразделение стадии T1
По данным ретроспективных когортных исследований, глубина и степень инвазии в собственную пластинку слизистой оболочки (подразделение стадии T1) имеют прогностическое значение [34,
35] (УД: 3). Такое разделение приводится в самой последней классификации Всемирной организации здравоохранения (ВОЗ) 2016 г. [36]. К настоящему времени не определена оптимальная система
разделения стадии T1 [36, 37].
4.4. Гистологическая градация неинвазивного переходно-клеточного рака мочевого пузыря
В 2004 г. ВОЗ и Международное общество урологической патологии (ISUP) опубликовали новую классификацию неинвазивных переходно-клеточных опухолей, которая дает другую стратификацию пациентов по отдельным группам по сравнению с более старой классификацией ВОЗ 1973 г. [36, 38] (табл. 4.2, 4.3, рис. 4.1). В 2016 г. было опубликовано обновление системы градации ВОЗ 2004 г., в котором не было значимых изменений [36]. Настоящие рекомендации по-прежнему основаны на классификациях 1973 и 2004/2016 гг., поскольку в большинстве публикаций используется классификация 1973 г. [39].
Таблица 4.2. Классификация степени злокачественности РМП по ВОЗ 1973 и 2004/2016 гг. [36]
Градация по ВОЗ 1973 г.
Переходно-клеточная папиллома
1-я степень: высокодифференцированная
2-я степень: умеренно дифференцированная
3-я степень: низкодифференцированная
Градация по ВОЗ 2004/2016 гг. (папиллярные образования)
Папиллярная переходно-клеточная опухоль низкого злокачественного потенциала (PUNLMP)
Переходно-клеточная карцинома низкой степени злокачественности
Переходно-клеточная карцинома высокой степени злокачественности
В систематическом обзоре и метаанализе не показано, что классификация 2004/2016 гг. превосходит классификацию 1973 г. в прогнозировании рецидива и прогрессирования [39]
(УД: 2a).
Следует отметить значительный сдвиг пациентов между прогностическими категориями в двух системах, например, увеличение числа пациентов с РМП высокой степени злокачественности (ВОЗ 2004/2016) вследствие включения части больных с РМП категории G2, несмотря на более благоприятный прогноз, чем у категории G3 (ВОЗ 1973) [39].
Согласно результатам многоцентрового анализа индивидуальных данных пациентов, за последние 10 лет пропорция опухолей, классифицируемых как PUNLMP, уменьшилась до очень низкого уровня [40]. Поскольку классификация ВОЗ 2004 г. к настоящему времени не полностью включена в прогностические модели, необходимо сравнить индивидуальные данные пациентов по обеим системам классификации при длительном
наблюдении.
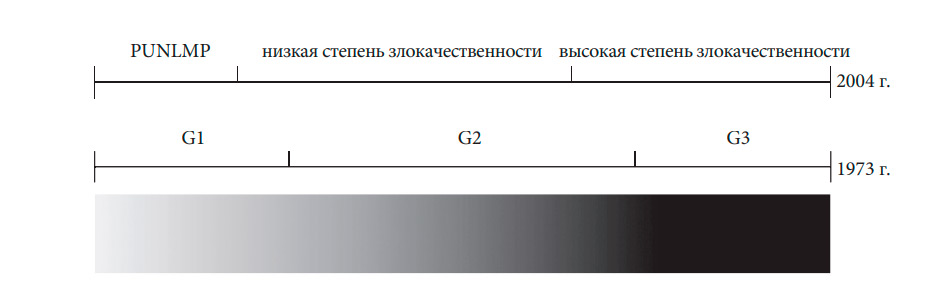
Гистологический спектр переходно-клеточного рака
Рис. 4.1. Стратификация опухолей в соответствии со степенью злокачественности по классификациям ВОЗ 1973 и 2004 гг. [41]*
* Опухоли G1 по классификации ВОЗ 1973 г. разделили на папиллярные переходно-клеточные образования низкого
злокачественного потенциала (PUNLMP) и рак низкой степени злокачественности в классификации ВОЗ 2004
и 2016 гг., а опухоли G2 – на опухоли низкой и высокой степени злокачественности. Все опухоли G3 по классификации
1973 г. классифицируются как опухоли высокой степени злокачественности (воспроизведено с разрешения Elsevier).
4.5. Карцинома in situ и ее классификация
Карцинома in situ представляет собой плоскую неинвазивную переходно-клеточную карциному высокой степени злокачественности. Ее можно пропустить во время цистоскопии или принять за
воспалительные изменения, если не выполнить биопсию. Она часто имеет мультифокальный характер и может развиваться не только в мочевом пузыре, но также в верхних мочевыводящих путях,
протоках предстательной железы и простатическом отделе уретры [42].
Классификация карциномы in situ по клиническому типу [43]:
- первичная: изолированная карцинома in situ при отсутствии ранее или одновременно выявленной папиллярной опухоли или ранее выявленной карциномы in situ;
- вторичная: карцинома in situ, выявленная во время контрольной цистоскопии у пациентов, у которых ранее были другие опухоли, но не карцинома in situ;
- сопутствующая: карцинома in situ при наличии любой другой переходно-клеточной опухоли в мочевом пузыре.
Таблица 4.3. Гистологическая классификация плоских образований ВОЗ 2004 г
- Пролиферация переходно-клеточного эпителия неясного злокачественного потенциала (плоский очаг изменений без атипии или папиллярных аспектов)
- Реактивная атипия (плоский очаг изменений с атипией)
- Атипия неясного значения
- Дисплазия переходно-клеточного эпителия
- Переходно-клеточная карцинома in situ всегда имеет высокую степень злокачественности
4.6. Вариабельность определения стадии и степени злокачественности между одним и разными исследователями
Наблюдаются значительные вариации среди морфологов в диагностике карциномы in situ, которая достигает согласия только в 70–78% случаев [41] (УД: 2a). Кроме того, существует вариабельность между исследователями в классификации опухолей стадии Та и отличии их от стадии Т1, а также в определении степени злокачественности по классификации 1997 и 2004 гг. В целом согласие по определению стадии и степени злокачественности составляет от 50 до 60% [45–48] (УД: 2a). В опубликованных сравнительных работах не подтверждено, что классификация ВОЗ 2004 г. имеет более высокую воспроизводимость, чем классификация 1973 г. [39].
4.7. Другие перспективные морфологические параметры
В настоящее время используется следующая классификация [49, 50]:
- Переходно-клеточный рак (более 90% случаев).
- Переходно-клеточные раки с частичной плоскоклеточной и/или железистой или трофобластной дифференцировкой.
- Микропапиллярный переходно-клеточный рак.
- Гнездный вариант (включая крупно-гнездный вариант) и микрокистозный переходно-клеточный рак.
- Плазмоцитоидный, гигантоклеточный, перстневидный, диффузный, недифференцированный рак.
- Лимфоэпителиома-подобный рак.
- Некоторые переходно-клеточные раки с другими редкими вариантами дифференцировки.
- Мелкоклеточные раки.
- Саркоматоидный переходно-клеточный рак.
Описаны также другие варианты, встречающиеся крайне редко.
Некоторые варианты переходно-клеточного рака (например, микропапиллярный, плазмоцитоидный, гнездовой, саркоматоидный) имеют менее благоприятный прогноз, чем классические папиллярные опухоли высокой степени злокачественности [2, 51–58] (УД: 3).
Наличие лимфососудистой инвазии (ЛВИ) в препарате после ТУР связано с повышенным риском последующего повышения стадии и неблагоприятным прогнозом [59–63] (УД: 3).
4.8. Молекулярная классификация
В настоящее время изучается прогностическая роль молекулярных маркеров [64–68]. Несмотря на то что они выглядят перспективными, в особенности сложные подходы, например стратификация
пациентов на основании молекулярной классификации, их не следует применять в рутинной клинической практике [69, 70].
4.9. Резюме по данным литературы и рекомендации по классификации рака мочевого пузыря
| Резюме по данным литературы | УД |
|---|---|
|
Глубина инвазии опухоли классифицируется в соответствии с системой TNM |
2a |
|
Папиллярная опухоль, ограниченная слизистой и подслизистой оболочкой, относится к стадии Та и T1 соответственно. Плоские, ограниченные слизистой оболочкой опухоли высокой степени злокачественности классифицируют как карциному in situ (Tis) |
2a |
|
Для гистологической классификации НИРМП следует использовать классификации ВОЗ 1973 и 2004 гг. |
2a |
| Рекомендация | СР |
|---|---|
|
Глубина инвазии опухоли классифицируется в соответствии с системой TNM 2017 г. |
Сильная |
|
Для гистологической классификации следует использовать классификации ВОЗ 1973 и 2004/2016 гг. |
Сильная |
|
Не используйте термин «поверхностный рак мочевого пузыря» |
Сильная |
|
При использовании термина «неинвазивный рак мочевого пузыря» в каждом конкретном случае следует указывать стадию и степень злокачественности |
Сильная |
5. Диагностика
5.1. Анамнез пациента
Тщательный сбор анамнеза является обязательным.
5.2. Признаки и симптомы
Наиболее частым симптомом при НИРМП является гематурия. По сравнению с микрогематурией макрогематурия в качестве первого симптома связана с более высокой степенью злокачественности [68]. Карциному in situ можно заподозрить у пациентов с симптомами нарушенного мочеиспускания, особенно накопительного характера.
5.3. Физикальное исследование
Обязательно проводится тщательное физикальное обследование, хотя оно не позволяет выявить НИРМП.
5.4. Методы визуализации
5.4.1. Компьютерная томография и экскреторная урография
Компьютерная томография (КТ) позволяет определить папиллярные опухоли мочевыводящих путей, которые могут выглядеть как дефекты наполнения или вызывать гидронефроз [72]. Экскреторная урография является альтернативным вариантом, если КТ недоступна [73] (УД: 2b), но, в частности, при ИРМП и раке верхних мочевыводящих путей КТ-урография более информативна, чем экскреторная урография (включая состояние лимфоузлов и прилегающих органов).
Необходимость выполнения КТ-урографии или экскреторной урографии во всех случаях обнаружения опухоли мочевого пузыря остается под вопросом из-за низкой частоты клинически значимых изменений [74–76] (УД: 2b). Частота опухолей верхних мочевыводящих путей невелика (1,8%), но она возрастает до 7,5% при РМП, располагающемся в зоне треугольника Льето [75] (УД: 2b). Риск обнаружения опухоли верхних мочевыводящих путей во время наблюдения возрастает при многочисленных опухолях и опухолях высокого риска [77] (УД: 2b).
5.4.2. Ультразвуковое исследование
Трансабдоминальное УЗИ проводится в дополнение к физикальному исследованию, поскольку метод имеет относительно высокую чувствительность в диагностике различных патологий верхних и нижних мочевыводящих путей. УЗИ позволяет охарактеризовать образования почек, выявить гидронефроз и внутрипросветные образования в мочевом пузыре, но не позволяет исключить все возможные причины гематурии [78, 79] (УД: 3). Кроме того, УЗИ не дает возможности исключить наличие опухолей в верхних мочевыводящих путях, поэтому оно может заменить КТ-урографию.
5.4.3. Мультипараметрическая магнитно-резонансная томография
Роль мультипараметрической магнитно-резонансной томографии (мпМРТ) в диагностике и стадировании РМП до конца не определена. Недавно опубликован стандартизированный протокол описания результатов МРТ у пациентов с РМП, однако необходимо провести его валидацию [80]. Методы визуализации (экскреторная урография, КТ-урография, УЗИ или МРТ) не позволяют выявить карциному in situ (УД: 4).
5.5. Цитологическое исследование мочи
Исследование собранной при мочеиспускании мочи или смывов из мочевого пузыря на предмет наличия слущенных опухолевых клеток имеет высокую чувствительность при опухолях G3/высокой степени злокачественности (84%), но низкую чувствительность при РМП G1/низкой степени злокачественности (16%) [81]. Чувствительность цитологического исследования в диагностике карциномы in situ составляет 28–100% [82] (УД: 1b). Цитологическое исследование представляет собой полезный метод, в частности, в качестве дополнения к цистоскопии при наличии РМП G3/высокой степени злокачественности или карциномы in situ. Положительный результат цитологического исследования мочи, полученной при мочеиспускании, указывает на переходно-клеточную опухоль в любом месте мочевыводящих путей; однако отрицательный результат анализа не позволяет исключать наличие опухоли в мочевыводящих путях.
Интерпретация цитологического исследования зависит от врача-лаборанта [83, 84]. На результат могут отрицательно повлиять небольшое количество клеток, инфекция мочевыводящих путей, наличие камней или внутрипузырные инстилляции, но у опытного специалиста специфичность метода превышает 90% [83] (УД: 2b).
В 2016 г. Парижская рабочая группа опубликовала стандартизированную систему описания результатов цитологического исследования мочи [85]:
- адекватность образца мочи (адекватность);
- отсутствие переходно-клеточного рака высокой степени злокачественности (отрицательный);
- атипический переходно-клеточный эпителий (AUC);
- подозрение на переходно-клеточный рак высокой степени злокачественности (подозрение);
- переходно-клеточный рак высокой степени злокачественности (HGUC);
- переходно-клеточный рак низкой степени злокачественности (LGUN).
Парижская система валидирована в ряде ретроспективных исследований [86, 87]. Сбор мочи проводится согласно рекомендациям, представленным в разделе 5.9. Как правило, достаточно одного центрифуга Cytospin из образца мочи [88]. При подозрительном результате цитологического исследования рекомендуется его повторить [89] (УД: 2b).
5.6. Исследование молекулярных маркеров в моче
Учитывая низкую чувствительность цитологического исследования мочи, разработаны многочисленные маркеры в моче [90]. Ни один из этих маркеров не принят в качестве стандартных анализов при диагностике или наблюдении в клинической практике или рекомендациях.
В отношении доступных в настоящее время анализов можно сделать следующие выводы:
- чувствительность обычно выше за счет более низкой специфичности, сравнимой с цитологическим исследованием мочи [91–96] (УД: 3);
- доброкачественные изменения и БЦЖ-терапия влияют на уровень многих маркеров в моче [91–93] (УД: 1b);
- чувствительность и специфичность анализа на маркеры в моче зависят от клинического контекста (скрининг, первичная диагностика, наблюдение (при высоком риске, низком / промежуточном риске)) [92, 93] (УД: 3);
- выбор пациентов объясняет широкий разброс информативности маркеров, а низкая воспроизводимость может быть связана с отбором пациентов и сложностью используемых
лабораторных методов [93, 94, 97–104]; - положительный результат цитологического исследования, тестов UroVysion (FISH), NMP-22, Ucyt+, FGFR3/TERT и анализа микросателлитов у пациентов с отрицательным результатом цистоскопии и отсутствием изменений в верхних мочевыводящих путях
связан с риском раннего рецидива и, возможно, прогрессирования [98, 100, 103–107] (УД: 2b); - если основной целью является не поиск маркеров с высокой чувствительностью и специфичностью, а отказ от выполнения ненужной цистоскопии, необходимо найти маркер
с очень высокой отрицательной прогностической ценностью. Тест, который позволит прогнозировать отсутствие опухоли, окажет большое влияние на рутинную клиническую практику [108]; - в настоящее время в проспективных исследованиях оценивают новые тесты, которые основаны на различных молекулярных маркерах и имеют очень хорошую отрицательную прогностическую ценность [97, 99, 109–112].
5.7. Практическое применение цитологического исследования мочи и маркеров
Необходимо учитывать цели цитологического исследования или молекулярных анализов мочи, перечисленные ниже.
5.7.1. Массовое обследование популяции, имеющей риск развития РМП
При скрининге на РМП в группах высокого риска для выявления гематурии можно применять анализ тест-полоской, а в случае положительного результата проводить исследование на FGFR3, NMP22 или UroVision [113, 114]. Низкая частота РМП в популяции и относительно длительное выполнение анализов ухудшают их применимость и экономическую эффективность [106, 114]. Регулярное применение для скрининга не рекомендуется [106, 113, 114].
5.7.2. Обследование пациентов с гематурией или другими симптомами, позволяющими заподозрить наличие РМП (первичное выявление)
В целом принято считать, что ни один из анализов не заменит цистоскопию. Однако цитологическое исследование мочи или анализ маркеров можно использовать в дополнение к цистоскопии для выявления невидимых опухолей, в особенности карциномы in situ. В этом случае особенно важны чувствительность и специфичность в диагностике опухолей высокой степени злокачественности.
5.7.3. Наблюдение неинвазивного рака мочевого пузыря
Проводились исследования, в которых сравнивали роль цитологического исследования мочи и анализа на маркеры во время наблюдения пациентов с НИРМП [97, 98, 110, 111, 115].
5.7.3.1. Наблюдение пациентов с неинвазивным раком мочевого пузыря высокого риска
Опухоли высокого риска следует выявлять на ранних этапах, а процент пропущенных опухолей должен быть как можно ниже. Следовательно, наилучшая стратегия наблюдения в таких случаях
включает частое проведение цистоскопии и цитологического исследования.
5.7.3.2. Наблюдение пациентов с неинвазивным раком мочевого пузыря низкого и промежуточного риска
Чтобы уменьшить количество выполняемых цистоскопий, маркеры в моче должны позволить определять рецидив до того, как опухоли станут крупными и множественными. Ограничение цитологического исследования мочи состоит в низкой чувствительности к рецидивам опухолей низкой степени злокачественности. Ряд маркеров в моче имеют более высокую информативность, но попрежнему не позволяют выявить половину опухолей низкой степени злокачественности, которые определяются при цистоскопии [92, 98] (УД: 1b).
Согласно современным данным, никакие маркеры в моче не могут заменить цистоскопию во время наблюдения и не позволяют снизить частоту выполнения цистоскопии. В одном из проспективных рандомизированных исследований показано, что наличие положительного результата анализа (анализа микросателлитов) позволяет улучшить качество контрольной цистоскопии [116] (УД: 1b). Это подтверждает вспомогательную роль неинвазивных анализов мочи, которые выполняются перед проведением контрольной
цистоскопии [116] (см. раздел 8.1).
5.8. Цистоскопия
Диагноз папиллярного РМП в конечном итоге зависит от цистоскопического осмотра мочевого пузыря и гистологического исследования резецированного материала. Для диагностики карциномы
in situ используют сочетание цистоскопии, цитологического исследования мочи и гистологического исследования биоптатов из нескольких участков мочевого пузыря [117].
Цистоскопию вначале проводят амбулаторно. Гибкий инструмент и топическое применение лубриканта с анестетиком позволяют с большей вероятностью провести исследование по сравнению с ригидным эндоскопом, особенно у мужчин [118, 119] (УД: 1b).
Рис. 5.1. Схема мочевого пузыря
5.9. Резюме по данным литературы и рекомендации по первичной диагностике неинвазивного рака мочевого пузыря
| Резюме по данным литературы | УД |
|---|---|
|
Диагностика РМП основана на цистоскопии |
1 |
|
Цитологическое исследование мочи имеет высокую чувствительность в выявлении опухолей высокой степени злокачественности, включая карциному in situ |
2b |
| Рекомендации | СР |
|---|---|
|
Необходимо собирать анамнез пациента |
Сильная |
|
УЗИ почек и мочевого пузыря и/или КТ-урографию (или экскреторную урографию) можно использовать при первичном обследовании пациентов с гематурией |
Сильная |
|
При первичной диагностике РМП КТ-урографию следует выполнять только в отдельных случаях (например, при локализации опухоли в зоне треугольника Льето, множественных опухолях или опухолях высокой степени злокачественности) |
Сильная |
|
Цистоскопия рекомендована всем пациентам с симптомами, подозрительными на РМП, или при наблюдении. Ее нельзя заменить цитологическим исследованием или какими-либо другими неинвазивными методами |
Сильная |
|
У мужчин необходимо использовать гибкий уретроцистоскоп, если он имеется в наличии. |
Сильная |
|
При цистоскопии необходимо описывать все макроскопические характеристики опухоли (локализацию, размер, количество и внешний вид) и изменения слизистой оболочки. Рекомендуется использовать схему мочевого пузыря (рис. 5.1) |
Сильная |
|
Рекомендуется использовать цитологический анализ мочи, полученной при мочеиспускании, в дополнение к цистоскопии для прогнозирования наличия опухолей высокой степени злокачественности |
Сильная |
|
Цитологическое исследование выполняют на свежем образце мочи с соответствующей фиксацией |
Сильная |
|
Для цитологического исследования используют не менее 25 мл свежей мочи или мочи с адекватной фиксацией. Утренняя моча не подходит для исследования из-за часто выявляемого цитолиза |
Сильная |
|
Для описания результатов цитологического исследования необходимо использовать Парижскую систему |
Сильная |
5.10. Трансуретральная резекция опухолей мочевого пузыря стадии Ta, T1
5.10.1. Стратегия операции
Цель операции ТУР при опухолях стадии Та, Т1 заключается в том, чтобы поставить правильный диагноз и полностью удалить все видимые образования. Эта операция крайне важна для диагностики и лечения РМП. ТУР следует проводить пошагово, соблюдая следующую схему [120, 121] (см. раздел 5.14).
Этапы операции, необходимые для успешного выполнения ТУР, включают оценку факторов, позволяющих определить риск заболевания (количество опухолей, размер, мультифокальный рост, характер роста, подозрение на наличие карциномы in situ, рецидивная или первичная опухоль), стадии (бимануальная пальпация под анестезией, оценка клинической стадии опухоли), адекватности резекции (визуально полная резекция, наличие мышцы в дне резекции) и осложнений (например, перфорации) [120, 121]. Для измерения размера самой крупной опухоли можно использовать резекционную петлю, диаметр которой составляет около 1 см. Характер роста опухоли может быть сидячим, узловым, папиллярным или плоским.
5.10.2. Хирургические и технические аспекты резекции опухоли
5.10.2.1. Хирургическая стратегия резекции (резекция по частям, en-bloc резекция)
Хорошая резекция обеспечивает благоприятный прогноз [114]. Полную резекцию можно выполнить по частям или en-bloc [120, 123].
- Резекция по частям (отдельные срезы экзофитной части опухоли, подлежащей стенки мочевого пузыря и краев резекции) дает хорошую информацию по вертикальному и горизонтальному распространению опухоли [124] (УД: 2b).
- При отдельных экзофитных опухолях можно выполнить резекцию en-bloc монополярной или биполярной петлей, тулиевым или гольмиевым лазером. Высокое качество резекции опухолей подтверждается наличием детрузора в 96–100% случаев [120, 125–128] (УД: 1b).
Стратегия резекции зависит от размера и локализации опухоли и опыта хирурга.
5.10.2.2. Оценка качества резекции
Показано, что отсутствие детрузора в препарате связано со значительно более высоким риском резидуальной опухоли, рецидива и недооценки стадии [129] (УД: 1b). Наличие детрузора в препарате считается суррогатным критерием качества резекции и является обязательным (кроме опухолей стадии TaG1/низкой степени злокачественности).
С накоплением опыта результаты ТУР улучшаются, что свидетельствует о роли программ обучения [131]. В настоящее время развивается виртуальное обучение на симуляторах [121]. Необходимо определить его роль в системе обучения.
5.10.2.3. Монополярная и биполярная резекция
По сравнению с монополярной резекцией биполярная электрокоагуляция позволяет уменьшить риск осложнений (например, перфорации мочевого пузыря из-за стимуляции запирательного нерва) и получить более качественный препарат для морфологического исследования. Тем не менее результаты остаются противоречивыми [132–135].
5.10.2.4. Амбулаторная фульгурация и лазерная вапоризация
У пациентов с небольшими опухолями стадии Ta низкой степени злокачественности/G1 в анамнезе прижигание (фульгурация) или лазерная вапоризация небольших папиллярных рецидивных образований в амбулаторных условиях позволяет уменьшить травматичность лечения [136, 137] (УД: 3).
К настоящему времени не проводилось проспективных сравнительных исследований, в которых бы оценивали онкологические результаты.
5.10.2.5. Резекция небольших папиллярных опухолей мочевого пузыря во время трансуретральной резекции предстательной железы
В литературе представлены ограниченные ретроспективные данные по результатам резекции папиллярных образований мочевого пузыря, выявленных во время цистоскопии перед ТУР предстательной железы. При условии папиллярного характера этих опухолей, относительно небольшого размера и небольшого числа после их резекции можно продолжить ТУР предстательной железы. При этом отсутствует точная оценка риска [138, 139].
5.10.3. Биопсия мочевого пузыря
Карцинома in situ может представлять собой бархатистый участок красноватого цвета, неотличимый от воспаления. Кроме того, она может быть невидимой. По этой причине рекомендуется брать
биопсию из всех участков измененного переходно-клеточного эпителия. При положительном результате цитологического исследования или наличии в анамнезе РМП G3/высокой степени злокачественности, а также при опухолях непапиллярного характера показана мультифокальная биопсия слизистой, имеющей нормальный вид, с картированием [140, 141]. Для получения репрезентативной картины необходимо взять биопсию слизистой из треугольника, основания, правой, левой боковой стенки, передней и задней стенки мочевого пузыря [140, 141]. При доступности оборудования фотодинамическая диагностика (ФДД) повышает чувствительность рандомной биопсии.
5.10.4. Биопсия простатического отдела уретры
У мужчин с НИРМП описано поражение простатического отдела уретры и протоков предстательной железы. Palou и соавт. [142] показали, что у 128 мужчин с РМП стадии Т1G3 частота карциномы in situ в простатическом отделе уретры составляла 11,7% (УД: 2b). Риск поражения простатического отдела уретры и протоков предстательной железы выше, если опухоль расположена в треугольнике Льето или шейке мочевого пузыря, при наличии карциномы in situ мочевого пузыря и множественных опухолей [143] (УД: 3).
На основании этих данных в ряде случаев рекомендуется выполнить биопсию простатической уретры (см. рекомендации в разделе 5.14) [142, 144, 145].
5.11. Новые методы визуализации опухоли
Стандартная цистоскопия и ТУР проводятся при обычном («белом») освещении. Однако использование такого освещения приводит к тому, что некоторые образования остаются невидимыми, в связи с чем были разработаны новые методы.
5.11.1. Фотодинамическая диагностика (флуоресцентная цистоскопия)
ФДД выполняется с использованием фиолетового освещения после введения в мочевой пузырь 5-аминолевулиновой кислоты (ALA) или гексаминолевулиновой кислоты (HAL). Показано, что биопсия и резекция с использованием флуоресцентного метода более чувствительны, чем стандартные операции, в выявлении злокачественных опухолей, в частности карциномы in situ [146, 147] (УД: 1a). Согласно результатам систематических обзоров и метаанализов, ФДД превышает по чувствительности эндоскопию при обычном освещении в объединенной оценке анализов как на уровне пациента (92 и 71%), так и на уровне биопсии (93 и 65%) [147]. В проспективном рандомизированном исследовании не подтверждено, что положительный результат цитологического исследования перед ТУР повышает частоту выявления РМП [148].
ФДД имеет более низкую специфичность, чем эндоскопия при обычном освещении (63 и 81%) [147]. Ложноположительные результаты возможны в случае воспаления, недавно выполненной ТУР и в первые три месяца после проведения БЦЖ-терапии [149, 150] (УД: 1a).
В проспективных рандомизированных исследованиях оценивали влияние ТУР с использованием ALA-флуоресценции на частоту рецидива РМП. В систематическом обзоре и метаанализе, включавшем 14 рандомизированных исследований (n = 2906), сравнивали ФДД с ALA (6 исследований) и HAL (9 исследований). Результаты свидетельствуют о снижении частоты рецидива при ближайшем и отдаленном наблюдении. При этом не выявлено различий в показателях прогрессирования и смертности. В анализе отмечены различия между исследованиями и риск искажений по технике операции и публикации результатов [151] (УД: 1a).
В рандомизированном исследовании показано снижение риска рецидива и прогрессирования после ТУР-биопсии под контролем ФДД по сравнению со стандартной ТУР-биопсией [152].
Данные результаты необходимо валидировать в последующих исследованиях.
5.11.2. Узкополосная визуализация
В методе узкополосной визуализации (NBI) повышается контраст между нормальным переходно-клеточным эпителием и опухолевой тканью с усиленным кровотоком. В когортных исследованиях, а также небольшом одноцентровом проспективном рандомизированном исследовании показано улучшение выявления рака при осмотре мочевого пузыря гибким цистоскопом в режиме NBI, биопсии и резекции под контролем NBI [153–156] (УД: 3b). В рандомизированном исследовании оценивали снижение риска рецидива РМП при использовании NBI во время ТУР. Несмотря на то что в целом в исследовании получены отрицательные результаты, при опухолях низкого риска (pTa низкой степени злокачественности, < 30 мм, отсутствие карциномы in situ) отмечалось снижение частоты рецидива [157] (УД: 1b).
5.11.3. Дополнительные технологии
Конфокальная лазерная микроэндоскопия основана на использовании визуализирующего датчика с высоким разрешением, разработанного для определения степени злокачественности во время эндоскопического исследования в режиме реального времени. Метод требует дальнейшей валидации [158]. Система профессионального усиления изображения Storz (IMAGE1 S, прежнее название SPIES) включает четыре различные линии спектра. К настоящему времени не получено проспективных данных [159].
5.12. Повторная резекция
5.12.1. Выявление резидуальных образований и повышение стадии опухоли
В литературе показан значительный риск резидуальной опухоли после ТУР РМП стадии Та, Т1 [123] (УД: 1b). По данным недавно опубликованного систематического обзора, в котором проанализировали 8409 пациентов с РМП стадии Ta/высокой степени злокачественности и T1, риск сохранения опухоли при стадии T1 составляет 51%, а недооценки стадии – 8%. В анализе также показан высокий риск резидуальной опухоли при РМП стадии Ta, но результаты основаны на небольшом количестве пациентов.
В большинстве случаев резидуальная опухоль выявляется в зоне первичной резекции [148] (УД: 1a).
По данным другого метаанализа (n = 3556), при стадии T1 частота выявления резидуальной опухоли и повышения стадии до ИРМП остается высокой даже в подгруппе пациентов с наличием детрузора в препарате. В подгруппе из 1565 больных РМП стадии T1 и наличием детрузора в препарате резидуальная опухоль выявлена в 58%, а в 11% случаев была повышена стадия [161].
5.12.2. Влияние повторной резекции на результаты лечения
Показано, что повторная ТУР повышает безрецидивную выживаемость (БРВ) [162, 163] (УД: 2a), улучшает результаты БЦЖ-терапии [164] (УД: 3) и дает важную прогностическую информацию [165–168] (УД: 3).
По данным ретроспективного анализа крупной когорты из 2451 пациента с РМП стадии T1G3/высокой степени злокачественности после БЦЖ-терапии, которым проводилось лечение в нескольких клиниках, выполнение повторной резекции (n = 935) улучшает БРВ, выживаемость без прогрессирования (ВБП) и общую выживаемость (ОВ) только при отсутствии детрузора в препарате после первой резекции [169] (УД: 3).
5.12.3. Время выполнения повторной резекции
В ретроспективном анализе показано, что повторная резекция через 14–42 дня повышает БРВ и ВБП по сравнению с ее выполнением через 43–90 дней [170] (УД: 3). На основании этих данных в отдельных случаях через 2–6 недель после первичной резекции рекомендуется повторная ТУР (в разделе 5.14 представлены рекомендации по отбору пациентов).
5.12.4. Запись результатов
Результаты повторной резекции (наличие резидуальной опухоли и повышение стадии) свидетельствуют о качестве первичной ТУР. С целью улучшения качества ТУР необходимо анализировать
результаты повторной резекции.
5.13. Морфологическое заключение
Морфологическое исследование препарата после ТУР и биопсии является важным этапом диагностики и определения тактики лечения РМП [171]. Рекомендуется тесное сотрудничество между урологом и морфологом. Для правильной патоморфологической оценки крайне важно высокое качество резецированной и отправленной на исследование ткани. Для правильной оценки категории Т требуется достаточное количество мышечной ткани. Чтобы получить всю необходимую информацию, при заборе ткани, обработке и исследовании необходимо соблюдать представленные ниже рекомендации (см. раздел 5.14) [172, 173]. В сложных случаях необходимо отправить препарат на пересмотр морфологу, специализирующемуся на патологии органов мочеполовой системы.
5.14. Резюме по данным литературы и рекомендации по ТУР мочевого пузыря и протоколу патоморфологического исследования
| Резюме по данным литературы | уд |
|---|---|
|
ТУР мочевого пузыря с последующим морфологическим исследованием препарата является важным этапом лечения НИРМП |
1 |
|
Отсутствие детрузора в препарате связано со статистически значимо более высоким риском резидуальной опухоли и недооценки стадии |
2b |
|
У пациентов с небольшими опухолями стадии Ta низкой степени злокачественности/(1 прижигание (фульгурация) небольших папиллярных рецидивных образований в амбулаторных условиях является эффективным и безопасным методом |
3 |
|
Повторная ТУР позволяет выявить резидуальные опухоли и недооценку стадии, повысить безрецидивную выживаемость, улучшить результаты БЦЖ-терапии и дает важную прогностическую информацию |
2 |
| Рекомендации | СР |
|---|---|
|
При подозрении на РМП рекомендуется выполнить ТУР с последующим морфологическим исследованием препарата в качестве метода диагностики и первого шага в лечении |
Сильная |
|
Пациентам с рецидивом небольших образований при наличии в анамнезе опухолей стадии Ta низкой степени злокачественности/Gl можно выполнять прижигание (фульгурацию) или лазерную вапоризацию в амбулаторных условиях |
Слабая |
|
ТУР следует проводить пошагово, соблюдая следующую схему:
|
Сильная |
|
Необходимо выполнить отдельные шаги: |
|
|
Резекция единым блоком или поэтапно, включения экзофитную часть опухоли, подлежащую стенку мочевого пузыря с детрузором и края зоны резекции. Кроме опухолей стадии TaG1, обязательно наличие детрузора в препарате |
Сильная |
|
Следует максимально избегать электрокоагуляции во время ТУР, чтобы не повредить препарат |
Сильная |
|
Необходимо взять биопсию из любого измененного участка. Биопсия внешне нормальной слизистой (треугольник Льето, дно мочевого пузыря, правая, левая, передняя и задняя стенки мочевого пузыря) рекомендуется только в случае положительного результата цитологического исследования мочи, опухоли высокой степени злокачественности/Ѳ3 в анамнезе или если экзофитная опухоль не выглядит как папиллярная. Если доступно оборудование, следует выполнить биопсию под контролем ФДД |
Сильная |
|
Биопсия простатического отдела уретры рекомендуется в тех случаях, когда опухоль расположена в шейке пузыря, имеется или подозревается карцинома in situ, положительный результат цитологического исследования без наличия опухоли в мочевом пузыре или при видимых изменениях в простатическом отделе уретры. Если биопсия не сделана в ходе первичной ТУР, ее необходимо выполнить при повторной резекции |
Сильная |
|
Биопсию простатической уретры берут из зоны изменений и преколликулярной области (между 5 и 7 часами условного циферблата) с помощью резекционной петли. При первичных неинвазивных опухолях, когда нет оснований подозревать прорастание в строму, можно выполнить «холодную» биопсию с помощью щипцов |
Слабая |
|
Для улучшения визуализации опухоли следует использовать дополнительные методы (ФДД, NBI), если они доступны |
Слабая |
|
Биоптаты из различных зон и резецированные фрагменты необходимо направлять морфологу в отдельных контейнерах и с отдельными надписями |
Слабая |
|
В протоколе ТУР следует описать локализацию, внешний вид и размер опухоли, все этапы операции, а также степень и полноту резекции |
Сильная |
|
При положительном результате цитологического исследования и отсутствии изменений при цистоскопии необходимо исключить переходно-клеточный рак верхних мочевыводящих путей, карциному in situ мочевого пузыря (мультифокальная биопсия или биопсия под контролем ФДД) и поражение простатического отдела уретры (биопсия) |
Сильная |
|
Показания для повторной ТУР включают следующее: |
|
|
Сильная |
|
При наличии показаний повторную ТУР выполняют через 2-6 недель после первой резекции. Она должна включать резекцию зоны локализации первичной опухоли |
Слабая |
|
Необходимо анализировать результаты повторной ТУР, поскольку они отражают качество первичной резекции |
Слабая |
|
Рекомендуется информировать морфолога о предыдущем лечении (внутрипузырная, лучевая терапия и т.д.) |
Сильная |
|
В протоколе гистологического исследования следует указать локализацию опухоли, ее степень злокачественности и стадию, наличие лимфососудистой инвазии или необычного гистологического варианта, наличие карциномы in situ и то, присутствует ли в препарате участок детрузора |
Сильная |
6. Прогнозирование рецидива и прогрессирования рака мочевого пузыря
6.1. Опухоли стадии Ta, T1
Тактика лечения зависит от прогноза пациента. Для индивидуального прогнозирования ближайшего и отдаленного риска рецидива и прогрессирования РМП группа по лечению рака мочеполовой системы Европейской организации по изучению и лечению рака (EORTC) разработала шкалы и таблицы рисков [161]. Они основаны на базе данных, включающей 2596 пациентов с РМП стадии Та и Т1, которые были рандомизированы в 7 исследованиях EORTC. Больных, у которых выявлена только карцинома in situ, в эту базу не включали. Внутрипузырная терапия, в основном химиотерапия, проводилась 78% пациентов. При этом им не выполнялась повторная ТУР или поддерживающий курс БЦЖ-терапии.
Балльная шкала оценки основана на шести наиболее важных клинических и патологических факторах, которые представлены в табл. 6.1. В ней также описана шкала, применяемая к различным факторам при расчете общего балла для оценки рецидива и прогрессирования. В таблице
6.2 показаны стратифицированные общие показатели по четырем категориям, которые отражают различные вероятности рецидива и прогрессирования через год и 5 лет [174] (УД: 2a).
| Балл по рецидиву | Вероятность рецидивирования в течение года | Вероятность рецидивирования в течение 5 лет | ||
|---|---|---|---|---|
|
% |
(95% ДИ) |
% |
(95% ДИ) |
|
|
0 |
15 |
(10-19) |
31 |
(24-37) |
|
1-4 |
24 |
(21-26) |
46 |
(42-49) |
|
5-9 |
38 |
(35-41) |
62 |
(58-65) |
|
10-17 |
61 |
(55-67) |
78 |
(73-84) |
| Балл по рецидиву | Вероятность рецидивирования в течение года | Вероятность рецидивирования в течение 5 лет | ||
|---|---|---|---|---|
|
% |
(95% ДИ) |
% |
(95% ДИ) |
|
|
0 |
15 |
(10-19) |
31 |
(24-37) |
|
1-4 |
24 |
(21-26) |
46 |
(42-49) |
|
5-9 |
38 |
(35-41) |
62 |
(58-65) |
|
10-17 |
61 |
(55-67) |
78 |
(73-84) |
| Балл по прогрессированию | Вероятность прогрессирования в течение года | Вероятность прогрессирования в течение 5 лет | ||
|---|---|---|---|---|
|
% |
(95% ДИ) |
% |
(95% ДИ) |
|
|
0 |
0,2 |
(0-0,7) |
0,8 |
(0-1,7) |
|
2-6 |
1 |
(0.4-1.6) |
6 |
(5-8) |
|
7-13 |
5 |
(4-7) |
17 |
(14-20) |
|
14-23 |
17 |
(10-24) |
45 |
(35-55) |
Примечание. Электронные калькуляторы для табл. 6.1 и 6.2 включены в мобильные приложения Apple
и Android по ссылке: https://www.eortc.be/tools/bladdercalculator/download_disclaimer.htm.
В недавно опубликованном исследовании авторы рассчитывали прогноз у пациентов с РМП промежуточного риска, которые получали химиотерапию. Больных РМП стадии Ta G1/G2, получивших химиотерапию, стратифицировали на три группы риска рецидива, в зависимости от наличия рецидива в анамнезе, ранее проводимой внутрипузырной химиотерапии, степени злокачественности, количества опухолей и проведения адъювантной химиотерапии [175].
Организация Club Urológico Español de Tratamiento Oncológico (CUETO) (Испанская группа по онкологической урологии) опубликовала шкалу оценки в баллах для пациентов, получавших БЦЖ-терапию,
которая позволяет прогнозировать ближайший и отдаленный риск рецидива и прогрессирования.
Она основана на анализе 1062 пациентов из четырех клинических исследований CUETO, в которых сравнивали различные варианты внутрипузырной БЦЖ-терапии. Пациенты получали 12 инстилляций в течение 5–6 месяцев, им не проводилось немедленной послеоперационной внутрипузырной химиотерапии или повторной ТУР. Шкала оценки включает семь прогностических факторов:
- пол;
- возраст;
- предыдущая частота рецидивов;
- количество опухолей;
- категория Т;
- сопутствующая карцинома in situ;
- степень злокачественности опухоли.
При использовании табл. 6.1 и 6.2 расчетный риск рецидива ниже, чем полученный по таблицам EORTC. Вероятность прогрессирования ниже только в случае РМП высокого риска [176] (УД: 2a).
Более низкий риск в таблицах CUETO может быть связан с использованием БЦЖ-терапии, которая является более эффективной формой внутрипузырной терапии.
Прогностическое значение шкалы EORTC подтверждено данными больных в исследованиях CUETO, которым проводилась БЦЖ-терапия, и отдаленными результатами наблюдения независимой группы пациентов [177, 178] (УД: 2a).
В исследовании EORTC 1812 пациентов с РМП промежуточного и высокого риска без карциномы in situ получали поддерживающий курс БЖЦ-терапии в течение 1–3 лет. Результаты показали, что предыдущая частота рецидивов и количество опухолей являются наиболее важными прогностическими факторами рецидива, стадия и степень злокачественности – прогрессирования заболевания и канцероспецифической выживаемости, а возраст и степень злокачественности – общей выживаемости. У пациентов с РМП стадии T1G3 прогноз неблагоприятный, с показателями одно- и пятилетней выживаемости без прогрессирования 11,4 и 19,8% соответственно. На основании этих данных разработаны новые таблицы риска EORTC для больных, которые получали
БЦЖ-терапию [179] (УД: 2a).
Для отдельных популяций пациентов описаны дополнительные прогностические факторы.
- При РМП стадии T1G3 женский пол и карцинома in situ в простатическом отделе уретры являются важными прогностическими факторами у пациентов, которым проводился индукционный курс БЦЖ-терапии, так же как и возраст, размер опухоли и наличие карциномы in situ у больных, получавших БЦЖ-терапию (у 62% выполнен только индукционный курс) [142, 180] (УД: 2b).
- Особое внимание следует уделять пациентам с РМП стадии T1G3 в псевдодивертикуле мочевого пузыря, поскольку в стенке дивертикула отсутствует мышечный слой [181] (УД: 3).
- При РМП высокого риска стадия опухоли при выполнении второй ТУР является неблагоприятным прогностическим фактором [166–168] (УД: 3).
- Рецидив после трех месяцев считается наиболее важным прогностическим фактором прогрессирования опухолей T1G2 после ТУР [182] (УД: 2b)
- Прогностическое значение морфологических факторов обсуждается в других разделах (см. раздел 4.6). Требуется провести больше исследований для оценки роли молекулярных маркеров в улучшении прогностической точности предложенных в настоящее время таблиц риска [177, 183].
- Предоперационное отношение нейтрофилов к лимфоцитам может иметь прогностическое значение при НИРМП, однако необходимо провести дальнейшую валидизацию [184].
6.2. Карцинома in situ
Без лечения карцинома in situ в 54% случаев прогрессирует до ИРМП [185] (УД: 3). К сожалению, отсутствуют достоверные прогностические факторы, однако в ряде исследований показано, что прогноз ухудшается при одновременном наличии карциномы in situ и опухолей стадии Т1 по сравнению с первичной карциномой in situ [186, 187], в случае обширной карциномы in situ [188] и карциномы in situ в области простатического отдела уретры [142] (УД: 3).
Ответ на внутрипузырную БЦЖ-терапию или химиотерапию является важным прогностическим фактором последующего прогрессирования и смерти от РМП [176–178, 182]. У 10–20% больных с полным ответом на терапию в последующем наблюдается прогрессирование до ИРМП, а при неэффективности внутрипузырной терапии этот показатель достигает 66% [189, 190] (УД: 2a).
6.3. Стратификация пациентов по группам риска
Рабочая группа ЕАУ рекомендует стратифицировать пациентов по трем группам риска. В таблице
6.3 представлены критерии этих групп риска с учетом вероятностей рецидивирования и в особенности прогрессирования из таблиц EORTC.
6.4. Подгруппа опухолей самого высокого риска
На основании прогностических факторов можно выделить из опухолей высокого риска группу с самым высоким риском прогрессирования. К ней относятся опухоли стадии T1G3/высокой степени злокачественности с сопутствующей карциномой in situ, множественные и/или крупные опухоли T1G3/высокой степени злокачественности и/или рецидивные опухоли T1G3/высокой степени злокачественности, T1G3/ высокой степени злокачественности + карцинома in situ в простатическом отделе уретры, некоторые редкие гистологические варианты и опухоли стадии T1 с лимфососудистой инвазией (табл. 6.3).
| Стратификация по группам риска | Характеристики |
|---|---|
|
Опухоли низкого риска |
Первичные единичные опухоли стадии Ta, (1 (PUNLMP, низкой степени злокачественности*), размером < 3 см, без карциномы in situ |
|
Опухоли промежуточного риска |
Все опухоли, не попадающие в две смежные категории (между категориями низкого и высокого риска) |
|
Опухоли высокого риска |
Любые из указанных ниже:
|
| Подгруппа опухолей самого высокого риска: | |
|
Опухоли стадии Т1(3/высокой степени злокачественности + карцинома in situ, множественные и/или крупные опухоли Т1(3/высокой степени злокачественности и/или рецидивные опухоли Т1(3/высокой степени злокачественности, Т1(3/высокой степени злокачественности + карцинома in situ в простатическом отделе уретры, опухоли необычного гистологического типа, лимфососудистая инвазия |
В таблице 7.2 представлено подразделение опухолей высокого риска для клинических интересов:
* низкая степень злокачественности включает G1 и G2;
** высокая степень злокачественности включает часть опухолей G2 и все опухоли G3 (см. рис. 4.1)
6.5. Резюме по данным литературы и рекомендации по стратификации неинвазивного рака
мочевого пузыря
| Резюме по данным литературы | УД |
|---|---|
|
Шкала EORTC и таблицы риска позволяют индивидуально прогнозировать ближайший и отдаленный риск рецидива и прогрессирования НИРМП |
2a |
|
Больных РМП стадии Ta G1/G2, получивших химиотерапию, можно стратифицировать на три группы риска рецидива в зависимости от наличия рецидива в анамнезе, ранее проводимой внутрипузырной химиотерапии, степени злокачественности, количества опухолей и проведения адъювантной химиотерапии |
2a-b |
|
Шкала CUETO позволяет прогнозировать ближайший и отдаленный риск рецидива и прогрессирования у больных, получавших БЦЖ-терапию в течение 5-6 месяцев |
2a |
|
У пациентов, которые получают поддерживающий курс БЦЖ-терапии, предыдущая частота рецидивов и количество опухолей являются наиболее важными прогностическими факторами рецидива; стадия и степень злокачественности являются наиболее важными прогностическими факторами прогрессирования заболевания и канцероспецифической выживаемости; возраст и степень злокачественности являются наиболее важными прогностическими факторами общей выживаемости |
2a |
| Рекомендации | СР |
|---|---|
|
Стратифицируйте пациентов по трем группам риска в соответствии с табл. 6.3 |
Сильная |
|
Используйте таблицы риска EORTC и калькуляторы для оценки индивидуального прогноза риска рецидива опухоли и ее прогрессирования спустя различное время после ТУР |
Сильная |
|
Для индивидуального прогнозирования рецидива и прогрессирования опухоли у пациентов, которые получают БЦЖ-терапию, следует использовать таблицы риска CUETO и новые таблицы риска EORTC |
Сильная |
7. Лечение
7.1. Рекомендации по прекращению курения
Показано, что курение повышает риск прогрессирования и рецидива опухоли [191, 192] (УД: 3). Хотя остается неясным, влияет ли отказ от курения положительно на результаты лечения РМП, всем курильщикам следует рекомендовать бросить курить, учитывая общие риски, связанные с курением табака [181, 193–195] (УД: 3).
7.2. Адъювантная терапия
7.2.1. Внутрипузырная химиотерапия
Хотя ТУР позволяет полностью удалить опухоли стадии Та, Т1, они могут рецидивировать и прогрессировать в ИРМП. Высокая вариабельность в трехмесячной частоте рецидива свидетельствует о том, что ТУР выполнена не полностью или провоцирует рецидив у значительной части пациентов [123]. По этой причине всем пациентам необходимо проводить адъювантную терапию.
7.2.1.1. Однократная немедленная послеоперационная внутрипузырная химиотерапия
Однократная немедленная внутрипузырная химиотерапия действует посредством разрушения циркулирующих опухолевых клеток после ТУР и аблативного влияния (хеморезекции) на резидуальные опухолевые клетки в зоне резекции и мелкие незамеченные опухоли [196–199] (УД: 3).
В четырех крупных метаанализах, которые включали от 1476 до 3103 больных, показано, что однократная немедленная внутрипузырная химиотерапия после ТУР значительно снижает частоту рецидивирования по сравнению с ТУР без химиотерапии [200–203] (УД: 1a). В систематическом обзоре и метаанализе индивидуальных данных 2278 пациентов [200] однократная внутрипузырная химиотерапия позволила снизить пятилетнюю частоту рецидивов на 14%, с 59 до 45%. Для профилактики одного рецидива в течение 5 лет необходимо пролечить 7 пациентов. Внутрипузырная химиотерапия эффективна только у пациентов с низкой частотой рецидива (один рецидив в год и реже) и показателем рецидива по шкале EORTC < 5. У больных с показателем по шкале EORTC 5 баллов и выше и/или частотой рецидива > 1 в год внутрипузырная терапия в виде однократного адъювантного лечения неэффективна.
К настоящему времени не проводилось рандомизированных исследований, посвященных сравнению препаратов [200–203].
В качестве внутрипузырной химиотерапии успешно применяются митомицин C (MMC), эпирубицин и пирарубицин [200]. По данным рандомизированного исследования (около 200 пациентов в каждой группе), однократная инстилляция гемцитабина по эффективности превосходит плацебо (физиологический раствор) [204], с низкими показателями токсичности [204].
Эти результаты противоречат предыдущему исследованию, в котором была ниже длительность инстилляции [205]. В исследовании Böhle и соавт. в обеих группах использовали промывную систему физиологическим раствором в течение 24 часов после операции, что может объяснять низкую частоту рецидива в контрольной группе и поднимает вопрос об эффективности промывной системы в профилактике раннего рецидива [205]. В двух метаанализах показана эффективность непрерывной ирригации мочевого пузыря физиологическим раствором для профилактики раннего рецидива [206, 207].
Профилактика имплантации опухолевых клеток должна проводиться в первые часы после ТУР. Уже через несколько часов клетки прочно имплантируются и покрываются межклеточным матриксом [196, 208–210] (УД: 3). Во всех исследованиях, в которых оценивали однократную внутрипузырную химиотерапию, ее проводили в течение 24 часов после операции. В двух рандомизированных исследованиях не выявлено эффективности однократного введения апазиквона; напротив, в дополнительном анализе показано снижение риска рецидива у пациентов, которым вводили апазиквон в течение 90 минут после ТУР [211]. Для достижения максимальной эффективности инстилляции рекомендуются гибкие методики, которые позволят начать химиотерапию как можно раньше после ТУР, желательно в течение первых двух часов, в палате пробуждения или даже непосредственно в операционной. Поскольку в случае экстравазации препарата у пациентов наблюдались тяжелые осложнения [212, 213], необходимо соблюдать меры предосторожности (см. раздел 7.5).
7.2.1.2. Дополнительная адъювантная внутрипузырная химиотерапия
Необходимость в последующей адъювантной внутрипузырной терапии зависит от прогноза. При РМП низкого риска (табл. 6.1, 6.2 и 6.3) однократная немедленная химиотерапия снижает риск рецидива и считается стандартным и полным вариантом лечения [200, 201] (УД: 1a). Для других групп риска, однако, однократная немедленная химиотерапия является недостаточным вариантом лечения из-за значительного риска рецидива и/или прогрессирования (табл. 6.1, 6.2 и 6.3).
В литературе опубликованы следующие сравнительные данные по эффективности.
Однократная инстилляция по сравнению с однократной инстилляцией и повторным введением препарата
В одном исследовании [214] показано, что последующие сеансы внутрипузырной химиотерапии после однократного введения препарата улучшают безрецидивную выживаемость при РМП промежуточного риска (УД: 2a).
Повторные инстилляции по сравнению с отсутствием адъювантной терапии
В крупном метаанализе, включавшем 3703 больных из 11 рандомизированных исследований, показана высокая статистическая значимость снижения риска рецидива на 44% в течение года в пользу химиотерапии по сравнению с ТУР без химиотерапии [215]. Это соответствует абсолютной разнице в 13–14% по количеству пациентов с рецидивами. В отличие от этих данных в двух метаанализах обнаружено, что БЦЖ-терапия уменьшает риск прогрессирования опухоли [216, 217] (УД: 1а) (см. раздел 7.2.2.1). Кроме того, поддерживающая БЦЖ-терапия значительно превосходит химиотерапию в профилактике рецидива [218–220] (см. раздел 7.2.2.1) (УД: 1a). Однако БЦЖ-терапия вызывает значительно больше побочных эффектов, чем химиотерапия [220] (УД: 1a).
Однократная инстилляция с повторным введением препарата по сравнению только с отсроченным введением препарата
По данным ряда исследований, у пациентов с РМП промежуточного риска ранняя инстилляция оказывает влияние на частоту рецидива даже при проведении повторных введений препарата [221– 224]. В рандомизированном исследовании, в которое вошло 2243 больных с НИРМП, сравнивали немедленную инстилляцию митомицина C с инстилляцией, выполненной через две недели после ТУР (с последующим проведением инстилляций в обеих группах). Согласно результатам, в группе немедленной инстилляции риск рецидива в течение трех лет снижался на 9%, с 36 до 27%. Эффект был статистически значимым в группе промежуточного и высокого риска у больных, получавших дополнительные адъювантные инстилляции митомицина C [221] (УД: 2a). К сожалению, критерии групп риска значительно отличались от рекомендуемых в настоящее время. Как следствие, ряд пациентов не получили адекватную терапию, и поэтому исследование не смогло достоверно ответить на вопрос, повышает ли проведение немедленной инстилляции после ТУР эффективность последующих инстилляций [225]. Необходимо с осторожностью интерпретировать результаты данного исследования, поскольку ряд пациентов не получили стандартного лечения (БЦЖ-терапия при РМП высокого риска). В рандомизированном исследовании, включавшем когорту пациентов с преобладанием РМП высокого риска, не показано эффективности однократного введения эпирубицина с последующей внутрипузырной химиотерапией или БЦЖ-терапией [226].
Оптимальная схема внутрипузырной терапии
Оптимальная длительность и частота сеансов химиотерапии не определены, однако ее не рекомендуется проводить более года [224] (УД: 3).
7.2.1.3. Оптимизация эффективности внутрипузырной химиотерапии
7.2.1.3.1.Изменение pH, длительности инстилляции и концентрации препарата
Изменение рН мочи, снижение диуреза и буферизация внутрипузырного раствора снижают частоту рецидивов [227] (УД: 1b). Часовой сеанс MMC превосходит по эффективности 30-минутный, но сравнения эффективности часовых и двухчасовых инстилляций не проводилось [228] (УД: 3). В другом рандомизированном исследовании с использованием эпирубицина обнаружено, что концентрация препарата важнее длительности сеанса [229] (УД: 1b). С учетом этих данных, рекомендуется предоставлять пациентам инструкции (см. раздел 7.5).
7.2.1.3.2.Внутрипузырная химиотерапия со вспомогательными методиками
Микроволновая гипертермия
Получены многообещающие данные о повышении эффективности MMC с использованием микроволновой гипертермии у пациентов с опухолями высокого риска [230]. В рандомизированном исследовании, в котором сравнивали БЦЖ-терапию и ММС с микроволновой гипертермией в течение года у пациентов с РМП промежуточного и высокого риска, показано снижение БРВ через 24 месяца в группе ММС [231] (УД: 1b).
Внутрипузырная химиотерапия с гипертермией
Описаны различные технологии для повышения температуры вводимого ММС, однако в настоящее время отсутствуют данные по их эффективности.
Электрофорез (EDMA)
В небольшом рандомизированном исследовании подтверждена эффективность ММС с использованием EDMA у больных с РМП высокого риска [215]. Тем не менее эти данные требуют подтверждения.
Применение вспомогательных методик при отсутствии ответа на БЦЖ-терапию описано в разделе 7.3.3.
7.2.1.4. Резюме по данным литературы – внутрипузырная химиотерапия
| Резюме по данным литературы | УД |
|---|---|
|
У пациентов с НИРМП, низкой частотой рецидива (один рецидив в год или реже) и показателем шкалы EORTC < 5 однократная немедленная внутрипузырная химиотерапия снижает частоту рецидива по сравнению с одной ТУР |
1a |
|
Однократная немедленная внутрипузырная химиотерапия влияет на частоту рецидива даже при проведении последующих сеансов химиотерапии |
3 |
|
При РМП промежуточного риска последующие сеансы внутрипузырной химиотерапии (после однократного введения химиопрепарата после ТУР или без него) улучшают безрецидивную выживаемость |
2a |
7.2.2. Внутрипузырная БЦЖ-иммунотерапия
7.2.2.1. Эффективность БЦЖ-терапии
Частота рецидива
В пяти метаанализах показано, что БЦЖ-терапия после ТУР превосходит одну ТУР или сочетание ТУР
с химиотерапией в профилактике рецидива НИРМП [218, 218, 233–236] (УД: 1a). В трех рандомизированных исследованиях, в которых сравнивали БЦЖ-терапию с комбинацией эпирубицина и интерферона [237], с MMC [238] и только с эпирубицином [219] у пациентов с опухолями промежуточного и высокого риска, подтверждено превосходство БЦЖ-терапии в отношении профилактики рецидива (УД: 1a). Влияние БЦЖ-терапии длительное [219, 238] и также выявлено в отдельном анализе пациентов с опухолями промежуточного риска [219]. В метаанализе [218] оценивали данные по 2820 пациентам, включенным в 9 рандомизированных исследований, в которых сравнивали эффективность ММС и БЦЖ-терапии. В исследованиях по поддерживающей БЦЖ-терапии отмечалось снижение риска рецидива в группе БЦЖ-терапии на 32% по сравнению с ММС, но при отсутствии поддерживающего курса наблюдалось повышение риска рецидива на 28%.
Предполагается, что для повышения эффективности ММС можно корректировать pH мочи, наряду с использованием альтернативных схем поддерживающей терапии. Ни один из этих аспектов не отражен
в цитированной выше литературе, поскольку в большинстве исследований не использовали данный подход.
Частота прогрессирования
В двух метаанализах обнаружено, что БЦЖ-терапия позволяет снизить риск или по меньшей мере отсрочить прогрессирование опухоли [216, 217, 236] (УД: 1a). В метаанализе, проведенном группой EORTCGUGC, оценивали данные 4863 больных, включенных в 24 рандомизированных исследования. Всего использовали пять разных штаммов БЦЖ, и в 20 из этих исследований проводили те или иные виды поддерживающей БЦЖ-терапии. При медиане наблюдения 2,5 года у 260 из 2658 пациентов (9,8%), получавших БЦЖ-терапию, наблюдалось прогрессирование РМП, по сравнению с 304 из 2205 (13,8%) в контрольных группах (только ТУР, ТУР + внутрипузырная химиотерапия или ТУР + другая иммунотерапия). Эти результаты свидетельствуют о снижении риска прогрессирования РМП на 27% при проведении поддерживающей БЦЖ-терапии. При этом у пациентов с папиллярными опухолями стадии Та, Т1 и карциномой in situ наблюдалось аналогичное снижение риска прогрессирования [217]. В недавно опубликованном рандомизированном исследовании с отдаленным наблюдением у больных в группе БЦЖтерапии была ниже частота развития отдаленных метастазов и выше общая и канцероспецифическая выживаемость по сравнению с внутрипузырной терапией эпирубицином [219] (УД: 1b). С другой стороны, в метаанализе данных отдельных пациентов не подтверждено статистически значимого различия между ММС и БЦЖ-терапией в отношении прогрессирования, выживаемости и причины смерти [218].
Противоречивые результаты исследований могут быть связаны с различными характеристиками пациентов, длительностью наблюдения, методологией и статистической мощностью. Однако в большинстве исследований выявлено, что БЦЖ-терапия, включая поддерживающий курс, приводит к уменьшению риска прогрессирования при опухолях высокого и промежуточного риска.
Влияние других факторов
Результаты двух других метаанализов свидетельствуют о возможных неточностях при отборе больных в группу БЦЖ-терапии, которые ранее получали внутрипузырную химиотерапию, что привело к превосходству БЦЖ-терапии [239]. Однако в самом последнем метаанализе показано, что поддерживающий курс БЦЖ-терапии более эффективен, чем ММС, вне зависимости от того, получали ли больные ранее химиотерапию [218] (УД: 1a).
Кроме того, БЦЖ-терапия менее эффективна у пациентов старше 70 лет, но при этом сохраняется ее превосходство над эпирубицином [240] (УД: 1a]. Согласно результатам когортного анализа, риск рецидива опухоли после БЦЖ-терапии выше у пациентов с раком верхних мочевыводящих путей в анамнезе [241].
7.2.2.2. Штаммы БЦЖ
В метаанализе, проведенном EORTC, не выявлено больших различий по эффективности между различными штаммами БЦЖ [241–243]. В недавно опубликованном сетевом метаанализе показано, что для внутрипузырной терапии используют 10 штаммов БЦЖ. При прямом и косвенном сравнении не выявлено различий по эффективности между различными штаммами [244].
Аналогичные результаты получены в опубликованном метаанализе проспективных рандомизированных исследований [217], недавно опубликованных результатах проспективного реестра [245], а также дополнительном анализе крупного проспективного исследования II фазы, в котором сравнивали БЦЖ-терапию и интерферон-α у пациентов, которым ранее не проводилась БЦЖ-терапия или у которых развился рецидив после БЦЖ-терапии [246] (УД: 2a). Тем не менее качество данных не позволяет сделать окончательные выводы.
7.2.2.3. Токсичность БЦЖ-терапии
После внутрипузырной БЦЖ-терапии чаще развиваются побочные эффекты по сравнению с внутрипузырной химиотерапией [217] (УД: 1a). Однако серьезные побочные эффекты наблюдаются менее чем у 5% пациентов и поддаются эффективному лечению практически во всех случаях [247] (УД: 1b). В когортном анализе реестра показано, что частота инфицирования БЦЖ после внутрипузырной терапии составляет 1% [248]. Показано, что схема поддерживающей терапии не связана с повышенным риском побочных эффектов по сравнению с индукционным курсом [247]. Побочные эффекты, которые привели к прекращению терапии, чаще развивались на первом году терапии [249]. С возрастом не возрастает частота побочных эффектов, приводящих к прекращению лечения [250] (УД: 2a). Между различными штаммами БЦЖ не выявлено различий в токсичности [245]. Симптомы могут быть следствием БЦЖ-терапии или связаны с самим заболеванием (распространенной карциномой in situ). По этой причине у значительного числа пациентов наблюдается уменьшение выраженности симптомов после завершения лечения [251].
Основные осложнения связаны с системной абсорбцией препарата. По этой причине необходимо учитывать противопоказания к внутрипузырной БЦЖ-терапии (см. раздел 7.5). Лейкоцитурия, микрогематурия или бессимптомная бактериурия не являются противопоказаниями к БЦЖтерапии, и в этих случаях не показана антибактериальная профилактика [100, 252, 253] (УД: 3).
БЦЖ-терапию следует с осторожностью применять (относительные противопоказания) у пациентов со сниженным иммунитетом (после иммуносупрессии, при наличии ВИЧ-инфекции) [254], хотя в ряде небольших исследований показана сопоставимая эффективность и частота осложнений по сравнению с пациентами с нормальным иммунным статусом. Роль профилактической противотуберкулезной терапии в таких случаях остается неясной [255–257] (УД: 3). Лечение побочных эффектов БЦЖ-терапии зависит от их типа и степени и проводится согласно рекомендациям Международной группы по раку мочевого пузыря (IBCG) и испанской группы [258, 259] (табл. 7.1).
| Варианты лечения местных побочных эффектов (модифицировано из группы IBCG) | |
|---|---|
| Симптомы цистита | Феназопиридин, пропантелина бромид или НПВС |
|
Если спустя несколько дней симптомы ослабевают: продолжать сеансы БЦЖ |
|
|
Если симптомы сохраняются или усиливаются: а. Отложить сеансы применения БЦЖ b. Провести посев мочи с. Начать эмпирическое лечение антибиотиками |
|
|
Если симптомы продолжают проявляться даже при лечении антибиотиками a. При положительном результате посева — антибиотики согласно чувствительности b. При отрицательном результате посева— хинолоны и, возможно, анальгетики и противовоспалительные в виде внутрипузырных инстилляций 1 раз в день в течение 5 дней (при необходимости повторить цикл) [223] |
|
|
Если симптомы не проходят: противотуберкулезные средства и глюкокортикоиды |
|
|
Если нет реакции на лечение и (или) отмечается сморщивание мочевого пузыря: радикальная цистэктомия |
|
|
Гематурия |
Посев мочи для исключения геморрагического цистита, если имеются другие симптомы |
|
Если сохраняется гематурия, выполнить цистоскопию для оценки наличия опухоли мочевого пузыря |
|
|
Симптоматический гранулематозный простатит |
Симптомы проявляются редко: посев мочи |
|
Хинолоны |
|
|
Если хинолоны неэффективны: изониазид (300 мг/сут) и рифампицин (600 мг/сут) в течение 3 месяцев |
|
|
Прекратить внутрипузырную терапию |
|
|
Эпидидимо орхит [224] |
Посев мочи, назначить хинолоны |
|
Прекратить внутрипузырную терапию |
|
|
Орхидэктомия при абсцессе или отсутствии ответа на лечение |
|
|
Варианты лечения в случае системных побочных эффектов |
|
|
Общее плохое самочувствие, лихорадка |
Обычно проходит самостоятельно в течение 48 часов с назначением жаропонижающих или без них |
|
Артралгия и/или артрит |
Редкое осложнение, считается аутоиммунной реакцией |
|
Артралгия: лечение НПВС |
|
|
Артрит: НПВС |
|
|
Постоянная фебрильная температура с высокой температурой (выше 38,5 °С в течение > 48 часов) |
Если ответа нет или он частичный, перейти на кортикостероиды, высокие дозы хинолонов или противотуберкулезные препараты [225] |
|
Абсолютное противопоказание к продолжению БЦЖ-терапии |
|
|
Немедленная оценка состояния: посев мочи, анализы крови, рентгенография органов грудной клетки |
|
|
Быстрое лечение более чем двумя антимикробными препаратами, пока проводится диагностическое обследование |
|
|
Консультация инфекциониста |
|
|
БЦЖ-сепсис |
Прекращение БЦЖ |
|
|
|
Аллергические реакции |
Антигистаминные и противовоспалительные препараты. |
|
Рассмотреть назначение хинолонов в высоких дозах или изониазида и рифампицина в случае сохранения симптомов. |
|
|
Отложить терапию до прекращения аллергической реакции. |
|
7.2.2.4. Оптимальный режим БЦЖ-терапии
Индукционный курс БЦЖ-терапии проводится по классической эмпирической 6-недельной схеме, предложенной Моралесом и соавт. [263]. Для оптимальной эффективности БЦЖ-терапия проводится в поддерживающем режиме [216–218, 236] (УД: 1a). Во многих исследованиях использовали поддерживающую терапию, начиная с 10 сеансов на протяжении 18 недель до 27 сеансов на протяжении трех лет [264]. В метаанализе группы EORTC авторы не смогли определить, какой из режимов поддерживающей БЦЖ-терапии был наиболее эффективным [217]. В своем метаанализе Böhle и соавт. пришли к выводу, что для получения преимущества перед ММС в профилактике рецидива или прогрессирования необходимо проводить поддерживающую терапию по меньшей мере в течение года [216] (УД: 1a).
Оптимальное количество инстилляций в индукционном цикле и оптимальная частота поддерживающих сеансов не определены. Кроме того, они могут отличаться для каждого отдельного пациента [265]. В рандоми зированных исследованиях, которые включали 1355 пациентов, группа EORTC показала, что трехлетний курс поддерживающей БЦЖ-терапии в полной дозе (три еженедельные инстилляции через 3, 6, 12, 18, 24, 30 и 36 месяцев) снижает частоту рецидивов по сравнению с курсом длительностью один год у пациентов с опухолями высокого, но не промежуточного риска. При этом отсутствовала разница в показателях прогрессирования или общей выживаемости. В группе трехлетней терапии 36,1% пациентов не завершили полную схему [266] (УД: 1b). По результатам рандомизированного исследования группы CUETO, включавшего 397 пациентов, при опухолях высокого риска поддерживающий курс с одной инстилляцией каждые три месяца не является оптимальным [267] (УД: 1b).
7.2.2.5. Оптимальная доза БЦЖ-терапии
Для уменьшения токсичности БЦЖ предлагается вводить более низкую дозу препарата. При этом показано, что при наличии мультифокальных опухолей более эффективна БЦЖ-терапия в полной дозе [268, 269] (УД: 1b). В исследовании CUETO сравнивали полную дозу и 1/3 полной дозы БЦЖ-терапии.
Результаты не показали различий в эффективности. Доза, равная 1/3 от стандартной, может быть минимально эффективной дозой для РМП промежуточного риска. Дальнейшее снижение дозы до 1/6 связано с уменьшением эффективности, при этом не наблюдается уменьшения токсичности [270] (УД: 1b).
Группа EORTC не обнаружила различий в токсичности между 1/3 и полной дозой БЦЖ-терапии, но на фоне 1/3 была выше частота рецидивов, в особенности при длительности терапии 1 год [249, 266] (УД: 1b). Кроме того, рутинное применение сниженной дозы затрудняется возможными техническими проблемами, связанными с ее правильной подготовкой.
7.2.2.6. Показания к БЦЖ-терапии
Хотя БЦЖ-терапия является очень эффективным методом лечения, достигнут консенсус о том, что ее не следует назначать всем пациентам с НИРМП в связи с риском токсичности. Решающее значение при выборе лечения имеет группа риска (табл. 6.2). Рекомендации для каждой группы риска представлены в разделе 7.5.
Заявление рабочей группы по недостаткам БЦЖ-терапии доступно по адресу :https://uroweb.org/guideline/non-muscle-invasive-bladder-cancer/?type=appendices-publications.
7.2.2.7. Резюме по данным литературы – БЦЖ-терапия
| Резюме по данным литературы | УД |
|---|---|
|
У пациентов с РМП промежуточного и высокого риска внутрипузырная БЦЖ-терапия после ТУР снижает риск рецидива и превосходит по эффективности одну ТУР или комбинацию ТУР и внутрипузырной химиотерапии |
1a |
|
Для оптимальной эффективности необходимо проводить поддерживающую БЦЖ-терапию |
1a |
|
При РМП высокого риска поддерживающая терапия длительностью три года более эффективна, чем длительностью один год, однако при опухолях промежуточного риска различия в эффективности отсутствуют |
1a |
7.2.3. Комбинированная терапия
7.2.3.1. Комбинация внутрипузырной БЦЖ-терапии и химиотерапии по сравнению с БЦЖ-терапией в режиме монотерапии
В рандомизированном контролируемом исследовании показано, что комбинация ММС и БЦЖ-терапии снижает частоту рецидивов, но обладает более высокой токсичностью по сравнению с монотерапией БЦЖ (УД: 1b). При одинаковой схеме проведения БЦЖ-терапии в обеих группах инстилляции в группе комбинированной терапии выполняли за день до введения ММС [271]. В рандомизированном исследовании, в котором сравнивали внутрипузырную химиотерапию ММС в сочетании с EMDA и комбинацию БЦЖ-терапии, ММС и EDMA, наблюдалось увеличение времени до рецидива и снижение показателей прогрессирования по сравнению с монотерапией БЦЖ [232, 272] (УД: 2). В двух метаанализах показано улучшение безрецидивной выживаемости, но выживаемость без прогрессирования была сопоставима в группе комбинированной терапии и БЦЖ-терапии в режиме монотерапии [272, 273].
7.2.3.2. Комбинированная терапия с применением интерферона
В Кокрейновском метаанализе, включавшем четыре рандомизированных исследования, в которые вошли пациенты с НИРМП и высоким риском рецидива и прогрессирования, комбинация БЦЖ-терапии и интерферона-2α не превосходит монотерапию БЦЖ по частоте рецидива и прогрессирования [274]. В другом рандомизированном исследовании обнаружено, что еженедельное введение ММС с последующей ежемесячной БЦЖ-терапией статистически значимо превосходит введение ММС с последующей ежемесячной БЦЖ-терапией и интерфероном по снижению частоты рецидива [275]. Кроме того, по данным рандомизированного исследования аналогичной популяции пациентов с НИРМП, в котором сравнивали монотерапию БЦЖ и комбинацию эпирубицина и интерферона при длительности наблюдения до двух лет, БЦЖ-терапия дает более низкую частоту рецидива [276] (УД: 1b).
7.2.4. Особенности лечения карциномы in situ
7.2.4.1. Тактика лечения
Выявление сопутствующей карциномы in situ повышает риск рецидива и прогрессирования РМП стадии Та, Т1 [174, 176], поэтому обязательно проводится дальнейшее лечение, согласно критериям, представленным в разделах 7.2.1, 7.2.2, 7.3 и 7.4. При карциноме in situ выполнение одной ТУР неэффективно.
В случае гистологического подтверждения карциномы in situ необходимо проводить дальнейшее лечение, или внутрипузырную БЦЖ-терапию, или радикальную цистэктомию (УД: 4). Хотя после ранней радикальной цистэктомии в случае карциномы in situ отмечается прекрасная канцероспецифическая выживаемость, 45–50% пациентов получают избыточное лечение [185] (УД: 3).
7.2.4.2. Когортные исследования внутрипузырной БЦЖ-терапии или химиотерапии
В ретроспективных исследованиях пациентов с карциномой in situ показатели полного ответа после внутрипузырной химиотерапии составили 48%, а после БЦЖ-терапии – 72–93% [185–188, 277] (УД: 2a).
У 50% больных с полным ответом на внутрипузырную терапию наблюдается рецидив с риском прогрессирования до инвазивного РМП и/или развития внепузырного рецидива [188, 210, 264, 277] (УД: 3).
7.2.4.3. Проспективные рандомизированные исследования внутрипузырной БЦЖ-терапии или химиотерапии
К сожалению, в литературе опубликовано всего несколько рандомизированных клинических исследований, включавших пациентов только с карциномой in situ. В метаанализе клинических испытаний, в которых сравнивали внутрипузырную БЦЖ-терапию и внутрипузырную химиотерапию у больных с карциномой in situ, в группе БЦЖ-терапии показано статистически значимое превосходство в отношении показателя ответа и уменьшение риска неэффективности лечения на 59% [278] (УД: 1a).
В метаанализе EORTC-GUCG, в котором оценивали частоту прогрессирования (подгруппа из 403 пациентов с карциномой in situ), БЦЖ-терапия снижала риск прогрессирования на 35% по сравнению с внутрипузырной химиотерапией или различными видами иммунотерапии [217] (УД: 1b). Комбинация БЦЖ-терапии и ММС не превосходит по эффективности одну БЦЖ-терапию [279]. В заключение, по сравнению с химиотерапией БЦЖ-терапия у пациентов с карциномой in situ повышает показатели полного ответа, общую пропорцию пациентов с отсутствием опухоли и уменьшает риск прогрессирования (УД: 1b).
7.2.4.4. Лечение внепузырной карциномы in situ
У пациентов с карциномой in situ повышен риск развития рака в верхних мочевыводящих путях и простатическом отделе уретры. Solsona и соавт. показали, что у 63% пациентов с карциномой in situ выявляется переходно-клеточный рак вне мочевого пузыря исходно или во время наблюдения [280]. В таких случаях выживаемость хуже, чем у пациентов с карциномой in situ только в мочевом пузыре [280] (УД: 3). В предстательной железе карцинома in situ может развиваться только в переходно-клеточном эпителии простатического отдела уретры или протоках предстательной железы [42]. Такие ситуации необходимо дифференцировать от инвазии опухоли в строму предстательной железы (РМП стадии Т4а), при которой обязательно проводится немедленная радикальная цистпростатэктомия. Пациентам с карциномой in situ в простатическом отделе уретры можно проводить внутрипузырную БЦЖ-терапию. ТУР предстательной железы позволяет улучшить контакт вакцины БЦЖ с простатическим отделом уретры [119, 281] (УД: 3). При этом следует учитывать воз можное распространение карциномы in situ; не рекомендуется использовать троакарную цистостому.
У пациентов с поражением протоков предстательной железы хорошие результаты БЦЖ-терапии показаны только в небольших исследованиях, поэтому в настоящее время недостаточно данных, чтобы сде-
лать убедительные рекомендации по тактике лечения, в связи с чем основным методом является радикальная цистэктомия [281, 282] (УД: 3).
7.2.4.5. Резюме по данным литературы – лечение карциномы in situ
| Резюме по данным литературы | УД |
|---|---|
| При карциноме in situ эндоскопического лечения недостаточно | 4 |
| По сравнению с внутрипузырной химиотерапией БЦЖ-терапия повышает частоту полного ответа, общий процент больных без рецидива и снижает риск прогрессирования опухоли |
1b |

Алгоритм 7.1. Стратегия лечения первичной или рецидивной опухоли(ей) у пациентов, которые не получали БЦЖ-терапию**
* Подробности и объяснения в тексте рекомендаций
7.3. Лечение при неэффективности внутрипузырной терапии
7.3.1. Неэффективность внутрипузырной терапии
У пациентов с рецидивом НИРМП после химиотерапии эффективна БЦЖ-терапия. Предыдущая химиотерапия не влияет на эффективность БЦЖ-терапии [218] (УД: 1a).
7.3.2. Рецидивы и неэффективность внутрипузырной БЦЖ-терапии
Предложены новые категории неэффективности внутрипузырной БЦЖ-терапии, традиционно включающей любой рецидив после лечения (табл. 7.2). Выявление НИМРП после БЦЖ-терапии можно описать как БЦЖ-рефрактерные опухоли, рецидив после БЦЖ-терапии и отсутствие ответа на БЦЖ-терапию. При рецидиве после БЦЖ-терапии прогноз лучше, чем при БЦЖ-рефрактерных опухолях [283]. Недавно предложено новое определение отсутствия ответа на БЦЖ-терапию для выделения подгруппы пациентов с более высоким риском прогрессирования, которым не показана дальнейшая БЦЖ-терапия [284]. Данное определение разработано совместно с FDA с целью сделать возможным проведение исследований без контрольной группы с частотой полного ответа и длительностью ответа в качестве первичных оцениваемых критериев. Это позволит получить данные по эффективности в поддержку регистрации новых препаратов, поскольку не разработано эффективной терапии при НИРМП и отсутствии ответа на БЦЖ-терапию [285].
| 1. Рецидив после БЦЖ-терапии |
|---|
| 1. Любой случай выявления инвазивного РМП во время наблюдения |
|
БЦЖ-рефрактерные опухоли:
|
|
Рецидив опухоли высокой степени злокачественности после БЦЖ-терапии |
| Рецидив опухоли G3/ высокой степени злокачественности (по ВОЗ 2004/1973) после завершения поддерживающего курса БЦЖ-терапии, несмотря на первоначальный ответ [247] (УД: 3) |
|
Отсутствие ответа на БЦЖ-терапию:
|
|
Непереносимость БЦЖ-терапии |
| Серьезные побочные эффекты, которые не позволяют продолжать БЦЖ-терапию до завершения индукционного курса [259] |
* Рецидив опухоли низкой степени злокачественности во время или после БЦЖ-терапии не считается неэффективностью БЦЖ-терапии.
** Адекватная БЦЖ-терапия определяется как завершение пяти из шести введений первичного индукционного курса и не менее чем два из шести введений второго индукционного курса или два из трех введений поддерживающего курса.
7.3.3. Лечение при неэффективности БЦЖ-терапии и рецидива после БЦЖ-терапии
Рекомендации по лечению представлены в табл. 7.5 и 7.7. Они отражают категории, описанные в табл. 7.2, и характеристики опухоли на момент возникновения рецидива.
У пациентов, у которых отсутствует ответ на БЦЖ-терапию, она маловероятно будет эффективна в дальнейшем; по этой причине предпочтительным вариантом лечения остается радикальная цистэктомия. Кроме того, описан ряд стратегий сохранения мочевого пузыря, которые можно разделить на такие категории, как цитотоксическая внутрипузырная химиотерапия [271], терапия с использованием дополнительных устройств (см. ниже), внутрипузырная иммунотерапия [289], системная иммунотерапия [290] или генная терапия [291–293].
В отдельных случаях при отсутствии ответа на БЦЖ-терапию данные варианты могут быть эффективны [289, 294–303] (УД: 3). В единственном рандомизированном исследовании, включавшем преимущественно пациентов с НИРМП высокого риска с неэффективностью по крайней мере предыдущего индукционного курса БЦЖ-терапии, двухлетняя безрецидивная выживаемость в группе комбинации митомицина C с микроволновой гипертермией составила 35% по сравнению с 41% в контрольной группе (проводилась БЦЖ-терапия, введение митомицина C или введение митомицина C с использованием EDMA по решению исследователя). По данным заранее спланированного анализаподгрупп, в группе митомицина C и микроволновой термотерапии была выше частота рецидива карциномы in situ, но ниже частота рецидива папиллярного РМП (24 и 53%) [304]. Недавно FDA одобрило системную иммунотерапию пембролизумабом на основании еще не опубликованных данных.
В настоящее время в случае отсутствия ответа на БЦЖ-терапию любые другие методы лечения, кроме радикальной цистэктомии, считаются онкологически менее эффективными [189, 286, 287] (УД: 3). В различных исследованиях показано, что БЦЖ-терапия подходит при рецидиве опухолей невысокой степени злокачественности и даже при некоторых рецидивных опухолях высокой степени злокачественности [294, 305] (УД: 3).
В литературе опубликовано недостаточно данных об оптимальном лечении пациентов с опухолями высокого риска, которые не смогли завершить курс БЦЖ-терапии из-за его непереносимости.
Рецидив опухоли низкой или промежуточной степени злокачественности после БЦЖ-терапии не следует расценивать как неэффективность БЦЖ-терапии. В таких случаях необходимо выбирать индивидуальную тактику, в зависимости от характеристик опухоли.
7.3.4. Резюме по данным литературы - лечение при внутрипузырномрецидиве
| Резюме по данным литературы | УД |
|---|---|
| Проведение внутрипузырной химиотерапии не влияет на эффективность БЦЖ-терапии | 1a |
| Радикальная цистэктомия превосходит по эффективности любые другие методы лечения при рецидиве после БЦЖ-терапии |
3 |
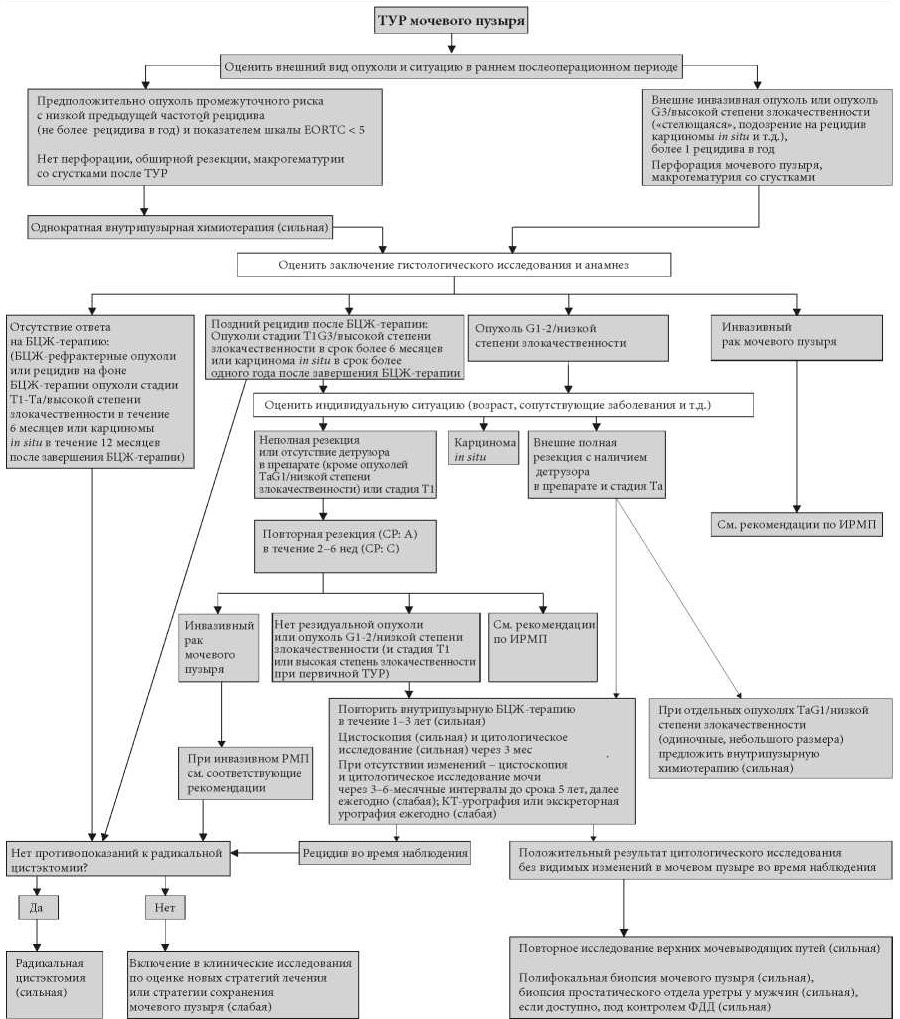
Алгоритм 7.2. Стратегия лечения при рецидиве во время или после внутрипузырной БЦЖ-терапии*
*подробности и объяснения в тексте рекомендаций
7.4. Радикальная цистэктомия при неинвазивном раке мочевого пузыря
Существует несколько причин, по которым ряду пациентов с НИРМП показана радикальная цистэктомия:
- низкая точность стадирования опухолей T1 при ТУР, и у 27–51% пациентов после ради-
кальной цистэктомии выявляется инвазивный РМП [145, 306–310] (УД: 3); - у некоторых пациентов с НИРМП развивается прогрессия до ИРМП (табл. 6.2);
- при прогрессировании неинвазивного РМП до инвазивного прогноз хуже, чем при «первичном» инвазивном РМП [311, 312].
Возможные преимущества радикальной цистэктомии необходимо взвешивать по отношению к риску, осложнениям и влиянию на качество жизни. Немедленную радикальную цистэктомию
обоснованно предлагать пациентам с НИРМП, у которых выявлен самый высокий риск прогрессирования (см. 7.6) [58, 142, 174, 176, 313] (УД: 3).
Немедленная радикальная цистэктомия настоятельно рекомендуется при отсутствии ответа на БЦЖ-терапию, как упоминалось выше. Задержка в проведении радикальной цистэктомии может привести к снижению канцероспецифической выживаемости [314] (УД: 3).
У больных, которым радикальная цистэктомия проводилась с гистологическим диагнозом
НИРМП, показатель пятилетней канцероспецифической выживаемости превышает 80% [315–317]
(УД: 3).
7.5. Рекомендации по адъювантной терапии опухолей стадии Ta, T1 и карциномы in situ
| Общие рекомендации | СР |
|---|---|
|
Курильщикам с подтвержденным НИРМП следует рекомендовать бросить курить |
Сильная |
|
Вид дальнейшей терапии после ТУР зависит от группы риска, согласно табл. 6.3 и разделу 7.6 |
Сильная |
|
Пациентам с опухолями низкого риска или опухолями промежуточного риска с низкой частотой рецидива (один рецидив в год или реже) и ожидаемым показателем рецидива по шкале EORTC < 5 рекомендуется однократная немедленная внутрипузырная химиотерапия |
Сильная |
|
Пациентам с опухолями промежуточного риска (в том числе после немедленной внутрипузырной химиотерапии) рекомендуется проводить БЦЖ-терапию в полной дозе в течение 1 года (индукционный курс + 3 еженедельные инстилляции через 3, 6 и 12 месяцев) или внутрипузырную химиотерапию (оптимальная схема неизвестна) в течение не более 1 года. Окончательный выбор зависит от индивидуального риска рецидива и прогрессирования, а также эффективности и побочных эффектов каждого метода лечения |
Сильная |
|
Пациентам с опухолями высокого риска показана внутрипузырная БЦЖ-терапия в полной дозе в течение 1-3 лет (индукционный курс + 3 еженедельные инстилляции через 3, 6, 12, 18, 24, 30 и 36 месяцев). Необходимо взвешивать дополнительный положительный эффект поддерживающей терапии на втором и третьем году с расходами, побочными эффектами и проблемами, связанными с нехваткой препаратов |
Сильная |
|
Пациентам с карциномой in situ в простатическом отделе уретры показана ТУР предстательной железы с последующей БЦЖ-терапией |
Слабая |
|
Пациентам с самым высоким риском прогрессирования (раздел 7.6) следует предлагать немедленную радикальную цистэктомию |
Сильная |
|
При отсутствии ответа на БЦЖ-терапию показана радикальная цистэктомия (см. раздел 7.7) |
Сильная |
|
При отсутствии ответа на БЦЖ-терапию и противопоказаниях к радикальной цистэктомии (вследствие сопутствующих заболеваний) рекомендуется стратегия сохранения мочевого пузыря (внутрипузырная химиотерапия, внутрипузырная химиотерапия с микроволновой гипертермией, внутрипузырная химиотерапия с использованием EDMA, внутрипузырная или системная иммунотерапия, предпочтительно в рамках клинических исследований) |
Слабая |
| Рекомендации - технические аспекты лечения | |
| Внутрипузырная химиотерапия | |
|
Если после ТУР необходимо провести однократную внутрипузырную терапию, она рекомендуется в течение 24 часов. |
Слабая |
|
Однократная немедленная внутрипузырная терапия не показана в случае выявленной/ предполагаемой внутри- или внебрюшинной перфорации (после обширной ТУР или при выраженной макрогематурии, которая требует промывания мочевого пузыря). |
Сильная |
7.6. Рекомендации по лечению опухолей стадии Ta, T1 и карциномы in situ в зависимости от группы риска
| Категория риска | Определение | Рекомендации по лечению |
|---|---|---|
|
Опухоли низкого риска |
Первичные, одиночные опухоли стадии Та, низкой степени злокачественности/Gl, PUNLMP, размером < 3 см, без карциномы in situ |
Однократная немедленная внутрипузырная химиотерапия после ТУР |
|
Опухоли промежуточного риска |
Все случаи, не попадающие в категорию низкого или высокого риска |
Пациентам с низкой частотой рецидива (один рецидив в год или реже) и ожидаемым показателем рецидива по шкале EORTC <5 рекомендуется однократная немедленная внутрипузырная химиотерапия после ТУР. Всем пациентам БЦЖ-терапия в полной дозе (индукционный курс + 3 еженедельных инстилляции через 3, 6 и 12 мес) или внутрипузырная химиотерапия (оптимальная схема неизвестна) в течение не более 1 года |
|
Опухоли высокого риска |
Любые из указанных ниже:
|
Внутрипузырная БЦЖ-терапия в полной дозе в течение 1-3 лет или цистэктомия (при опухолях самого высокого риска - см. ниже) |
|
Подгруппа опухолей самого высокого риска |
||
|
ТЮ3/высокой степени злокачественности с сопутствующей карциномой in situ мочевого пузыря, множественные и/или рецидивные опухоли T1G3 и/или крупные опухоли T1G3, T1G3 в сочетании с карциномой in situ в простатическом отделе уретре, некоторые гистологические варианты, лимфососудистая инвазия (см. разделы 4.7 и 6.4 |
Следует рассмотреть выполнение радикальной цистэктомии. Если пациент отказывается или имеет противопоказания к радикальной цистэктомии, показана БЦЖ-терапия в полной дозе в течение 1-3 лет |
|
7.7. Рекомендации по лечению больных с неэффективностью БЦЖ-терапии
| Категория | Рекомендации по лечению | СР |
|---|---|---|
|
Отсутствие ответа на БЦЖ-терапию |
1. Радикальная цистэктомия |
Сильная |
|
2. Включение в клинические исследования по оценке новых стратегий лечения |
Слабая |
|
|
3. Стратегии сохранения мочевого пузыря у пациентов, которые не подходят или отказываются от цистэктомии |
Слабая |
|
|
Рецидив опухоли стадии Tl-Ta/высокой степени злокачественности в срок более 6 месяцев или карцинома in situ в срок более года после завершения БЦЖ-терапии |
1. Радикальная цистэктомия или повторный курс БЦЖ-терапии в зависимости от индивидуальной ситуации |
Сильная |
|
2. Стратегии сохранения мочевого пузыря |
Слабая |
|
|
Рецидив после БЦЖ-терапии низкой степени злокачественности после лечения первичной опухоли промежуточного риска |
1. Повторный курс БЦЖ-терапии или химиотерапии |
Слабая |
|
2. Радикальная цистэктомия |
Слабая |
8. Наблюдение за пациентами с неинвазивным раком мочевого пузыря
Из-за риска рецидива и прогрессирования пациентам с НИРМП необходимо проводить регулярное обследование после лечения. Однако частота выполнения цистоскопии и методов визуализации и длительность периода наблюдения должны соответствовать индивидуальному риску. Используя таблицы риска (табл. 6.1 и 6.2), можно прогнозировать ближайший и отдаленный риск рецидива и прогрессирования у отдельных пациентов и соответствующим образом определить схему наблюдения (см. раздел 8.1) [174, 176]. Следует отметить, что рекомендации по наблюдению основаны преимущественно на результатах ретроспективных исследований и в литературе отсутствует достаточное количество рандомизированных исследований, в которых бы оценивали возможность безопасного уменьшения частоты цистоскопии.
При планировании схемы наблюдения и методов необходимо учитывать следующие аспекты.
- Своевременное выявление ИРМП и рецидива НИРМП G3/высокой степени злокачественности имеет крайне важное значение, поскольку задержка в диагностике и лечении может представлять угрозу для жизни.
- Рецидив РМП группы низкого риска почти всегда имеет низкую стадию и G1/низкую степень злокачественности. Небольшие неинвазивные (Та) папиллярные опухоли G1/низкой степени злокачественности не создают немедленную опасность для пациента, и их раннее выявление не является существенно важным для успешного лечения [318, 319] (УД: 2b). Хорошим и безопасным методом для снижения травматичности лечения является амбулаторное прижигание (фульгурация) небольших папиллярных рецидивных опухолей [320] (УД: 3). Многие авторы рекомендуют в отдельных случаях временное активное наблюдение [321–323] (УД: 3).
- Первая цистоскопия через 3 месяца после ТУР является очень важным прогностическим фактором рецидива и прогрессирования [182, 189, 324–326] (УД: 1a). Всем пациентам с РМП стадии Та, Т1 и карциномой in situ обязательно необходимо провести первую цистоскопию через 3 месяца после ТУР.• Риск рецидива у больных с РМП низкого риска после пятилетнего периода без рецидива мал [325] (УД: 3). В таких случаях можно отказаться от цистоскопии или заменить ее менее инвазивными методами через 5 лет наблюдения [326].
- У больных с РМП промежуточного и высокого риска рецидивы после десятилетнего периода без рецидива не являются необычным [327] (УД: 3). Следовательно, рекомендуется пожизненное наблюдение [326].
- При определении схемы наблюдения необходимо учитывать риск внепузырного рецидива (простатический отдел уретры у мужчин и верхние мочевыводящие пути у лиц обоих полов).
- Риск рецидива в верхних мочевыводящих путях увеличивается в случае множественных опухолей и опухолей с высокой степенью злокачественности [77] (УД: 3).
- Положительный результат исследования мочи оказывает положительное влияние на качество контрольной цистоскопии [116] (УД: 1b), что подтверждает вспомогательную роль исследования мочи во время наблюдения.
- При первичном диагнозе РМП стадии Ta/G1-2/низкой степени злокачественности и невозможности/отказе пациента от проведения цистоскопии можно выполнять УЗИ мочевого пузыря [328].
- В настоящее время нет неинвазивных методик, которые могли бы заменить цистоскопию.
8.1. Резюме по данным литературы и рекомендации по наблюдению пациентов с неинвзивным раком мочевого пузыря
| Резюме по данным литературы | УД |
|---|---|
|
Первая цистоскопия через 3 месяца после ТУР является важным прогностическим фактором рецидива и прогрессирования |
1a |
|
Риск рецидива в верхних мочевыводящих путях увеличивается в случае множественных опухолей и опухолей с высокой степенью злокачественности |
3 |
| Рекомендации | СР |
|---|---|
|
Контрольное обследование при РМП стадии Та, Т1 и карциноме in situ основано на регулярной цистоскопии |
Сильная |
|
Пациентам с РМП низкого риска стадии Ta необходимо выполнять цистоскопию через 3 месяца после операции. При отсутствии рецидива следующую цистоскопию рекомендуется проводить через 9 месяцев, а затем ежегодно на протяжении 5 лет |
Слабая |
|
Пациентам с РМП высокого риска необходимо выполнять цистоскопию и цитологическое исследование мочи через 3 месяца после операции. При отсутствии рецидива следующая цистоскопия и цитологическое исследование должны проводиться через каждые 3 месяца в течение 2 лет, а затем каждые 6 месяцев до достижения пятилетнего периода, после этого - ежегодно |
Слабая |
|
Схема наблюдения пациентов с РМП промежуточного риска стадии Ta включает цистоскопию и цитологическое исследование, частота которых определяется индивидуально |
Слабая |
|
При РМП высокого риска необходимо регулярно (ежегодно) проводить визуализацию верхних мочевыводящих путей (КТ-урография или экскреторная урография) |
Слабая |
|
При выявлении изменений на амбулаторной цистоскопии или положительном результате цитологического исследования необходимо выполнить цистоскопию под анестезией с биопсией мочевого пузыря |
Сильная |
|
При положительном результате цитологического исследования мочи и отсутствии видимых изменений в мочевом пузыре рекомендуется выполнить мультифокальную биопсию или биопсию с ФДД (если имеется такое оборудование) и исключить переходно-клеточный рак внепузырной локализации (КТ-урография, биопсия простатического отдела уретры) |
Сильная |
|
При первичном диагнозе РМП стадии Ta/Gl-2/низкой степени злокачественности и невозможности/отказе пациента от проведения цистоскопии можно выполнять УЗИ мочевого пузыря |
Слабая |
9. Литература (представлена в конце издания)
10. Конфликт интересов
Все члены группы по составлению клинических рекомендаций по НИРМП предоставили открытый отчет по всем взаимоотношениям, которые они имеют и которые могут быть восприняты как причина конфликта интересов. Эта информация доступна на сайте Европейской ассоциации урологов: https://uroweb.org/guideline/non-muscle-invasive-bladder-cancer/?type=panel..
Данные рекомендации были созданы при финансовой поддержке ЕАУ. При этом не использовались внешние источники финансирования и поддержки. ЕАУ – некоммерческая организация, финансовые издержки которой ограничиваются административными расходами, а также оплатой поездок и встреч. Авторам рекомендаций ЕАУ не предоставляла гонораров или какой-либо другой компенсации.
11. Информация по цитированию
Формат, по которому необходимо цитировать рекомендации ЕАУ, варьирует в зависимости от типа журнала. Соответственно может отличаться количество авторов или, например, данные об издателе, местоположении или номере ISBN.
Ссылка на полную версию рекомендаций оформляется следующим образом: EAU Guidelines. Edn. presented at the EAU Annual Congress, Amsterdam, the Netherlands, 2020.
ISBN 978-94-92671-07-3.
Если требуется издатель и/или местоположение:
EAU Guidelines Office, Arnhem, The Netherlands. http://uroweb.org/guidelines/compilations-of-all-guidelines/
Ссылки на отдельные рекомендации оформляются следующим образом:
Имена авторов. Название источника. Тип публикации. ISBN. Издатель и его местоположение, год.
Клинические рекомендации EAU
Клинические рекомендации
Европейской
ассоциации
урологов
Клинические рекомендации Европейской ассоциации урологов 2020
Введение
Мы с гордостью представляем версию Клинических рекомендаций Европейской ассоциации урологов (ЕАУ) 2020 года. Рекомендации ЕАУ являются наиболее полными в своем роде, они постоянно обновляются и доступны для урологов и врачей смежных специальностей. Они составляются отделом ЕАУ по клиническим рекомендациям, который включает около 250 международных экспертов и 72 про¬фессиональных сообщества по всему миру. Клинические рекомендации ЕАУ признаются во всем мире в качестве важного ресурса, который помогает врачам в повседневной практике.
В настоящей версии мы с гордостью представляем новый раздел по сексуальной функции и ре-продуктивному здоровью у мужчин, в подготовке которого принимали участие эксперты из рабочих групп по мужскому бесплодию, мужской сексуальной дисфункции и мужскому гипогонадизму. Соот¬ветственно обновлены различные рекомендации.
В отделе ЕАУ по клиническим рекомендациям подготовлены планы на следующий год и после-дующий период. Мы рады объявить о создании новой рабочей группы по ненейрогенным симптомам нарушенного мочеиспускания у женщин под руководством м-ра C.K. Harding (председатель) и проф. д-ра M.C. Lapitan (вице-председатель). Рабочая группа уже приступила к работе над новым разделом ре¬комендаций, который будет опубликован в 2021 году. Кроме того, к 2021 году рабочей группой под пред¬седательством проф. д-ра N. Lumen будут подготовлены дополнительные рекомендации ЕАУ по стрик¬турам уретры.
Смотря вперед, можно сказать, что основная цель рекомендаций ЕАУ - максимально привлечь пациентов к их разработке. Конечной целью этого проекта является создание эффективных рамок, что¬бы мнение пациентов при разработке будущих рекомендаций учитывалось и этот процесс был плодот¬ворным, а не символическим. Отдел ЕАУ по клиническим рекомендациям предполагает, что структу¬рированное участие пациентов приведет к созданию рекомендаций, которые обеспечат более высокую комплаентность методам лечения и улучшение показателей здоровья, способствуя реализации пациент- ориентированной концепции, основанной на интересах больных. Это является сложной задачей, но она оправданна в отдаленной перспективе.
В Европе клинические рекомендации, как национальные, так и международные, не соблюдают¬ся должным образом. Чтобы обеспечить соблюдение рекомендаций, необходимо понимать, что препят¬ствует данному процессу и что может способствовать их эффективному внедрению. Для решения этих проблем группа IMAGINE разработала двухэтапную программу для: (i) анализа применения рекомен¬даций в Европе при сотрудничестве с национальными обществами урологов; (ii) понимания проблем и факторов, способствующих соблюдению рекомендаций. Проект IMAGINE начал свою работу в марте 2020 года и будет способствовать дальнейшей оптимизации и гармонизации урологической практики в Европе, что позволит повысить качество урологической помощи и улучшить результаты лечения па¬циентов.
Наконец, необходимо отметить, что ежегодная публикация рекомендаций ЕАУ была бы невоз¬можной без всесторонней поддержки исполнительного комитета ЕАУ и управляющей команды, группы экспертов и молодых помощников, членов ЕАУ, национальных урологических ассоциаций и каждого пользователя рекомендаций по всему миру. По этой причине от имени совета отдела по клиническим рекомендациям ЕАУ хотелось бы поблагодарить вас за вашу поддержку и вдохновение.
Мы надеемся, что вам понравится использовать клинические рекомендации ЕАУ 2020 года.
Проф. д-р James N’Dow, председатель отдела ЕАУ по клиническим рекомендациям Проф. д-р Мария Рибал, вице-председатель отдела ЕАУ по клиническим рекомендациям Члены совета отдела ЕАУ по клиническим рекомендациям
Члены совета отдела ЕАУ по клиническим рекомендациям










Отдел ЕАУ по клиническим рекомендациям создал специальные комитеты, ответственные за критические аспекты разработки рекомендаций.
Создание клинических рекомендаций является одним из ключевых видов деятельности Европей¬ской ассоциации урологов (ЕАУ), и рекомендации 2020 года охватывают большую часть урологиче¬ских заболеваний. Клинические рекомендации ЕАУ, которые обновлены по результатам системати¬ческих обзоров доступных клинических данных, направлены на поддержку врачей-клиницистов в процессе оказания помощи пациентам.
Настоящие рекомендации составлены отделом клинических рекомендаций, состоящим бо¬лее чем из 300 врачей. Их усилия поддерживаются несколькими экспертными комитетами, каждый из которых имеет свои специфические задачи и ответственность.
Отдел клинических рекомендаций ЕАУ создал стандартную методологию, направленную:
- на обеспечение научного качества, точности и новизны информации;
- обеспечение постоянного улучшения качества;
- внесение вклада в распространение и применение всех публикаций ЕАУ.
Доступ ко всем разделам рекомендаций можно получить на сайте ЕАУ www.uroweb.org/guidelines/. Все полноправные члены ЕАУ могут получить полную и карманную версии рекомен¬даций в печатном виде во время ежегодного конгресса ЕАУ. Кроме того, доступно для скачивания мобильное приложение, в котором представлена карманная версия рекомендаций.
Подготовка систематических обзоров
Отдел рекомендаций ЕАУ разработал структуру для проведения систематических обзоров с участи¬ем молодых урологов (помощников в составлении рекомендаций), которых поддерживают методо¬логи и статистики. Систематические обзоры посвящены клиническим вопросам, устанавливаемым в качестве приоритетных членами рабочих групп, занимающихся каждым разделом, и их результа¬ты включают в рекомендации сразу же после их появления. В рекомендациях подробно описыва¬ются преимущества и недостатки вмешательств на стадии развития клинического вопроса и при включении результатов анализа и составлении рекомендаций по лечению. Если это возможно, при написании рекомендаций и определении вопросов для систематических обзоров мы стараемся учи¬тывать точку зрения пациентов. Организации пациентов приглашаются для участия в анализе ре¬комендаций ЕАУ перед их публикацией. Это повторяющаяся программа, направленная на большую часть ключевых клинических вопросов, охватываемых рекомендациями ЕАУ.
Все систематические обзоры проводились по стандартной методологии базы данных Кохрана (http://www.cochranelibrary.com/about/about-cochrane-systematic-reviews.html). Два незави¬симых эксперта просматривали тезисы и полнотекстовые статьи, проводили анализ данных, оцени¬вали риск неточностей и выполняли упражнение GRADE [1-4]. Результаты представлялись в таб¬лицах, в которых были показаны исходные характеристики и основные результаты. Метаанализы проводились только в рамках систематического обзора, если в литературе опубликовано несколько рандомизированных исследований по одному вопросу со схожим описанием результатов. При низ¬ком уровне данных проводился описательный анализ. Эксперты следовали предпочтительным для систематических обзоров и метаанализов сообщениям о результатах исследований (PRISMA) [5]. Независимо от систематических обзоров каждая рабочая группа проводила отдельный системати¬ческий обзор, посвященный своему разделу рекомендаций. Он представлял собой обширный поиск (Scope/Horizon), целью которого было:
- обеспечить получение доступных клинических данных в структурированном виде без искажения;
- убедиться, что не будут пропущены важные данные;
- информировать о необходимости обновления рекомендаций;
- выявить пробелы в литературе и определить приоритет для последующих систематических обзоров.
Результаты поиска отбирались и оценивались по структурированной схеме членами рабочих групп и помощников, хотя они не составляли подробного отчета. История поиска доступна в онлайн-режиме в разделах «Приложения» и «Публикации» для каждой темы рекомендаций (www.uroweb.org/guidelines/).
Уровень доказательность и степень рекомендаций
В пересмотр 2018 года отдел ЕАУ по клиническим рекомендациям внедрил модифицированную методологию GRADE во все 20 разделов рекомендаций [4]. Для каждой рекомендации в онлайн-режи- ме заполняется форма для определения силы с учетом ряда основных элементов:
- общее качество данных в поддержку рекомендаций; ссылки, используемые в этом тексте,
градируются по степени согласно системе, модифицированной из классификации Оксфордского центра медицинских исследований, основанной на доказательствах [6];
- выраженность эффекта (индивидуальный или комбинированный эффект);
- убедительность результатов (точность, согласованность, неоднородность и другие статистические или связанные с исследованиями факторы);
- баланс между желательными и нежелательными исходами;
- влияние ценностей и предпочтений пациента на вмешательство;
- точность этих ценностей и предпочтений пациента.
Эти элементы стали основой, которую рабочая группа использует для определения силы каждой рекомендации. Она в свою очередь описана терминами «сильная» или «слабая» [7]. Сила каждой рекомендации определяется балансом между желательными и нежелательными последствиями альтернативных стратегий, качеством данных (включая точность критериев) и природой и вариабельностью ценностей и предпочтений пациентов. С целью консультирования таблицы опубликованы онлайн.
Уровни доказательности*
| Уровень | Тип данных |
|---|---|
| 1а | Доказательства получены в результате метаанализа рандомизированных исследований |
| 1b | Доказательства получены в результате хотя бы одного рандомизированного исследования |
| 2а | Доказательства получены в результате хотя бы одного хорошо организованного контролируемого, но не рандомизированного исследования |
| 2b | Доказательства получены в результате хотя бы одного хорошо организованного экспериментального исследования другого типа |
| 3 | Доказательства получены в результате хорошо организованных неэкспериментальных описательных исследований, таких как сравнительные исследования, корреляционные исследования и исследования отдельных случаев |
| 4 | Доказательства основаны на сообщении и мнении комитета экспертов или клиническом опыте уважаемых авторов |
*С изменениями из [6].
Литература
- Atkins D. et al. Grading quality of evidence and strength of recommendations. BMJ. 2004; 328: 1490.
- Guyatt G. et al. Grading strength of recommendations and quality of evidence in clinical guidelines: report from an American College of Chest Physicians task force. Chest. 2006; 129: 174.
- Guyatt G.H. et al. What is "quality of evidence" and why is it important to clinicians? BMJ. 2008; 336: 995
- Guyatt G.H. et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008; 336: 924.
- Moher D. et al. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. J. Clin. Epidemiol. 2009; 62: 1006.
- Phillips B. et al. Oxford Centre for Evidence-based Medicine Levels of Evidence. Updated by Jeremy Howick March 2009.
- Guyatt G.H. et al. Going from evidence to recommendations. BMJ. 2008;p 336: 1049.
Следующие национальные урологические ассоциации внесли вклад в разработку рекомендаций ЕАУ:
Поддержка национальных обществ
Кроме того, отдел ЕАУ по клиническим рекомендациям выражает огромную благодарность Европейскому совету по урологии
Состав рабочих групп по клиническим рекомендациям
Рецензенты клинических рекомендаций ЕАУ (в алфавитном порядке)
Руководитель проекта – М.А. Газимиев
Рецензенты клинических рекомендаций ЕАУ
(русскоязычной версии)
(в алфавитном порядке)
Аббревиатуры
Микоуреаплазмозы (уреаплазмозы, микоплазмозы)
Mycoplasma genitalium – патогенный микроб, с абсолютной патогенностью, который может вызывать уретриты у мужчин; уретриты, цервициты и ВЗОМТ у женщин. Mycoplasma hominis, Ureaplasma urealyticum, Ureaplasma parvum – условно-патогенные микроорганизмы, которые иногда (при снижении иммунитета) могут вызывать уретриты, цервициты, циститы, такие осложнения течения беременности как замершая (неразвивающаяся), осложнения после родов и абортов – чаще при сочетании с такими ЗППП, как трихомониаз, гонорея, хламидиоз. Главными факторами агрессивности микоплазм являются адгезины, способствующие адгезии микробов на клетках хозяина, что определяет ведущее значение в развитии инициальной фазы инфекционного процесса; эндотоксины; ферменты агрессии и продукты их метаболизма.
Микоплазмы относятся к Mollicutes, для которых характерно: наиболее мелкие свободноживущие саморазмножающиеся прокариоты, с размерами как у вирусов; отсутствие жесткой клеточной стенки, в отличии от бактерий, которая заменена на трехслойную цитоплазматическую мембрану; наличие в клетках одномоментно ДНК и РНК, возможность к вегетированию на питательных средах без наличия клеток, размножаться путем бинарного деления, разнообразие клеток, восприимчивость к некоторым антибиотикам – в отличии от вирусов. Микоплазмы обладают способностью к адгезии и вегетированию на мембране клеток эукариот, в отличии от хламидий.
Структура и размеры микоплазм могут меняться в зависимости от возраста культуры для выращивания, сред и условий культивирования. Микоплазмы относятся к роду Mycoplasma, куда входят около 100 видов.
Но вызывают развитие воспалительных процессов мочеполовых органов у мужчин и женщин только некоторые микоуреаплазмы:
- Строго абсолютный патогенный микроб Mycoplasma genitalium
- Условно-патогенные микробы: Mycoplasma hominis, Ureaplasma urealyticum, Ureaplsma parvum.
M. genitalium - это подвижная бактерия, имеющая колбообразную форму и удлиненную терминальную структуру, которая обеспечивает скользящее движение, с проникновением в слои слизи на поверхности эпителиальных клеток, фиксацией к клеткам и дальнейшим проникновением, что обеспечивается нейраминсодержащими рецепторами и чем объясняется выраженное патогенное действие на клетки и формирование клетками воспалительного ответа на них.
Наименьшая величина генома выявлена у M. genitalium из всех микоплазм и других микроорганизмов, которые саморазмножаются, что значительно усложняет ее научное исследование, связанное со сложностью и длительностью культивирования (1-5 мес) в связи с высокой избирательностью и требовательностью M. genitalium к средам для вегетирования. Это связано с небольшим количеством генов, участвующих в механизме ферментации питательных веществ, необходимых для роста и развития микроорганизма.
M. genitalium обладают склонностью к цилиндрическому эпителию и, соответственно, к поражению слизистых оболочек уретры и цервикального канала. Инфицирование M. genitalium взрослых мужчин и женщин происходит незащищенным половым путем, детей – как интранатальным (во время родов), так и половым путем. Значение M. genitalium, как причины в развитии эпидидимитов и простатитов, до конца не доказана.
Ureaplasma
Уреаплазмы относятся к отдельному роду Ureaplasma семейства Mycoplasmataceae. Отличия, обнаруженные в генах уреазы, разделяют биовары на отличающиеся один от другого: биовар 1 – U.parvum, биовар 2 – U.urealyticum.
Согласно экспертизе ВОЗ от 2006 г., U.urealyticum является потенциальным возбудителем неспецифических не гонококковых уретритов у мужчин и, возможно, воспалительных заболеваний органов малого таза (ВЗОМТ) у женщин. Хотя эксперты CDC от 2010 (США) не считают до конца доказанной причинную роль генитальных микоплазм (за исключением M. genitalium) в развитии воспалительных процессов мочеполовой системы.
Эпидемиология заболеваний, вызванных микоуреаплазмами
Частота выявления M. genitalium у больных воспалительными заболеваниями органов мочеполовой системы составляет, от 10% до 45%, у 11,5-41,7% больных негонококковыми уретритами, 3-54,5% больных негонококково - нехламидийными уретритами и у 7-10% женщин с ВЗОМТ.
Статистика обнаружения условно-патогенных генитальных микоплазм (Ureaplasma spp. и Mycoplasma hominis) отличается в различных группах населения, составляя от 10% до 50% (по данным некоторых исследований – до 80%). Ureaplasma spp и M. hominis иногда выявляются у клинически здоровых лиц (в 5-20% наблюдений), и при некоторых условиях способны вызывать инфекционно-воспалительные заболевания мочеполовой системы.
Классификация микоуреаплазмозов
Клинические формы, неосложненные:
- Уретриты, вызванные M. genitalium.
- Цервициты, вызванные M. genitalium.
- Уретриты, вызванные Ureaplasma spp (и/или) M. hominis.
- Цервициты, вызванные Ureaplasma spp (и/или) M. hominis.
- Вагиниты, вызванные Ureaplasma spp (и/или) M. hominis.
Клинически формы, осложненные:
- Циститы, вызванные Ureaplasma spp (и/или) M. hominis.
- Сальпингоофориты, вызванные M.genitalium.
- Эндометриты, вызванные M. genitalium.
Клиника микоуреаплазмозов
Клиника болезней, вызванных M. genitalium (уретриты, цервициты), с течением без осложнений.
Более 50% женщин переносят инфицирование M. genitalium без выраженной симптоматики. Клинически яркая картина проявляется разнообразными симптомами: выделениями из уретры, половых путей слизи, гноя; ацикличными кровянистыми выделениями; болезненностью сексуальных контактов (диспареуния) и мочеиспусканий (дизурией); зудом, жжением; дискомфортом, тяжестью или болью в нижней части живота. При объективном обследовании у женщин выявляют: покраснение и отечность слизистой оболочки, инфильтрацию стенок уретры, слизистой оболочки шейки матки, выделения из мочеиспускательного или цервикального канала слизи, гноя.
Основными жалобами мужчин являются: необильные выделения из уретры слизи, гноя; зуд, жжение, дизурия; дискомфорт, зуд, жжение в области уретры; диспареуния; частое мочеиспускание, с ургентными позывами к мочеиспусканию (характерными для проксимальной локализации воспалительного процесса); боли в промежности, с иррадиацией в прямую кишку. При объективном обследовании у мужчин выявляют: покраснение и отечность слизистой оболочки наружного отверстия мочеиспускательного канала, инфильтрация его стенки; выделения из мочеиспускательного канала слизи, гноя.
Клиника болезней, вызванных M. genitalium, с осложненным течением.
Основными жалобами женщин являются:
- сальпингоофорит: боли схваткообразного характера в нижней части живота, с выделениями из половых путей слизи, гноя; при хроническом течении заболевания субъективные проявления менее выражены, с более частыми нарушениями менструального цикла;
- эндометрит: тянущие боли в нижней части живота, с выделения из половых путей слизи, гноя; при хроническом течении заболевания субъективные проявления менее выражены, с более частыми меж менструальными скудными кровянистыми выделениями.
При объективном обследовании женщин выявляют:
- сальпингоофорит: в острой фазе воспаления органов мочеполовой системы определяются увеличенные, резко болезненные маточные трубы и яичники, укорочение сводов влагалища при пальпации, обильное количество слизи, гноя из канала шейки матки; в хронической фазе – незначительная болезненность, уплотнение маточных труб при пальпации;
- эндометрит: для острой фазы воспаления характерно болезненное увеличение матки мягковатой консистенции при пальпации, с обильным количеством слизи, гноя из канала шейки матки; при хроническом течении заболевания – плотная консистенция и ограниченная подвижность матки при пальпации.
Болезни, вызванные Ureaplasma spp. и/или M. hominis (уретриты, цервициты)
Клиника болезней, вызванных Ureaplasma spp. и/или M. hominis (уретриты, цервициты), неосложненного течения.
Основными жалобами женщин являются: выделения из мочеиспускательного канала, половых путей слизи, гноя; диспареуния; зуд, жжение, дизурия; дискомфорт, боль в нижней части живота. При объективном обследовании женщин выявляют: покраснение и отечность слизистой оболочки наружного отверстия мочеиспускательного канала, с инфильтрацией его стенок, необильным выделениями из уретры слизи, гноя; слизистой оболочки влагалища и шейки матки, с наличием выделений в боковых и заднем сводах влагалища, цервикального канала слизи, гноя.
Основными жалобами мужчин являются: необильные выделения из мочеиспускательного канала слизи, гноя; зуд, жжение, дизурия; дискомфорт в области уретры; диспареуния; учащенное мочеиспускание и неотложные позывы на мочеиспускание (при проксимальной локализации воспалительного процесса); боли в промежности с частой иррадиацией в область прямой кишки. При объективном обследовании мужчин выявляют: покраснение и отечность слизистой оболочки наружного отверстия мочеиспускательного канала, с инфильтрацией его стенок и выделениями из уретры слизи, гноя.
Лабораторная диагностика болезней, вызванных микоуреаплазмами:
Диагностика болезней, вызванных M. genitalium
Обследование на M. genitalium обязательно проводят:
- мужчинам и женщинам с наличием клинических, лабораторных признаков воспалительного процесса органов мочеполовой системы;
- при обследовании половых партнеров перед планированием беременности;
- беременным женщинам;
- во время предоперационной подготовке перед оперативными (инвазивными) манипуляциями или вмешательствами на органах мочеполовой системы;
- лицам с не вынашиванием беременности и бесплодием в анамнезе;
- половым партнёрам больных ЗППП;
- лицам, перенесшим сексуальное насилие
- больным ЗППП (трихомониаз, гонорея, хламидиоз)
- больным с рецидивами воспалительного процесса после лечения выявленных накануне и пролеченных ЗППП
- лицам, часто меняющих половых партнеров и не использующих при этом барьерных методов контрацепции.
Диагностику урогенитальных болезней, вызванных M. genitalium, проводят лабораторными молекулярно-биологическими методами, с целью обнаружения специфических фрагментов ДНК (метод ПЦР) и/или РНК (метод NASBA) в отделяемом слизистых оболочек женских половых органов, мочеиспускательного канала, секрета предстательной железы, спермы, с чувствительностью 98-100%, специфичностью - 100%, на которые могут влиять различные подавляющие факторы, для минимизации которых строго контролируется организация и режим работы лабораторий, для исключения заражения клинического материала чужеродными примесями.
Условиями получения максимально точных результатов лабораторной диагностики является:
- сроки забора анализов для выявления M. genitalium методом амплификации РНК (NASBA) –проводят не ранее, чем через 14 дней после окончания приема антибиотиков; методом амплификации ДНК (ПЦР, ПЦР- real-time) – не ранее, чем через месяц после окончания антибиотикотерапии;
- забор отделяемого из мочеиспускательного канала проводят не ранее, чем через 3 часа после последнего мочеиспускания, а при наличии обильных выделений из уретры – через 15-20 минут после мочеиспускания;
- забор анализов из канала шейки матки и влагалища производят вне периода менструации;
- строгое соблюдение условий доставки образцов в лабораторию.
При наличии острой фазы уретрита у мужчин, исследуют первую порцию мочи.
Другие методы лабораторных исследований, такие как культуральный, прямой иммунофлюоресценции (ПИФ), иммуноферментного анализа (ИФА) для обнаружения антител к M. genitalium на данный момент массово не используются вследствие значительно более низкой чувствительности и специфичности. Не используют биологические, химические и алиментарные провокации для повышения точности диагностики и для лечения урогенитальных болезней, вызванных M. genitalium.
Диагностика болезней, вызываемых Ureaplasma spp., M. Hominis
Обследование на Ureaplasma spp., M. hominis проводят при наличии у пациента клинико-лабораторных признаков воспалительного процесса в органах мочеполовой системы, дисбиоза вагинального микробиоценоза, при отсутствии в предыдущих анализах выявленных абсолютных возбудителей ЗППП (трихомониаза, гонореи, хламидиоза).
При отсутствии клинико-лабораторных признаков воспалительного процесса в мочеполовых органах обследуют на Ureaplasma spp. и/или M. hominis доноров спермы; пациентов с диагнозом бесплодие; пациенток, имеющим в анамнезе не вынашивание беременности и перинатальные потери.
Проводят идентификацию Ureaplasma spp., M. hominis молекулярно-биологическими методами ПЦР, направленными на обнаружение специфических фрагментов ДНК микроорганизмов в отделяемом из уретры мужчин, секрете предстательной железы, сперме; отделяемом женских половых органов с чувствительностью 98-100%, специфичностью - 100%, на которые могут влиять различные подавляющие факторы, для минимизации которых строго контролируется организация и режим работы лабораторий, для исключения заражения клинического материала чужеродными примесями.
Также используют для идентификации Ureaplasma spp., M.hominis методы микробиологического (культурального) исследования отделяемого женских половых органов; мочеиспускательного канала, секрета предстательной железы, спермы мужчин на Ureaplasma urealyticum, M. hominis. («Mycoplasma DUO» для выявления и «SIR Mycoplasma» - для определения чувствительности Ureaplasma urealyticum, M. hominis к антибиотикам), с чувствительностью 95-98% и специфичностью – 90-95%.
После выявления уреаплазм и микоплазм обязательно проводится лабораторно-микроскопическое исследование клинического материала с дальнейшей оценкой степени лейкоцитарной реакции (воспаления) и состояния микробиоценоза уретры, влагалища, цервикального канала у женщин; уретры, предстательной железы и спермы у мужчин.
Лабораторными показателями наличия воспаления в уретре (уретрита) у мужчин, являются обнаружение: в мазках из уретры более 5 лейкоцитов в поле зрения при просмотре более 5 полей зрения при световой микроскопии, при увеличении 1 х1000; в осадке первой порции мочи более 10 лейкоцитов при увеличении светового микроскопа 1 х400.
Лабораторными показателями наличия уретрита у женщин является обнаружение более 10 лейкоцитов в поле зрения в мазках из уретры; вагинита, является обнаружение более 15-20 полиморфно ядерных лейкоцитов в поле зрения в мазках из влагалища, а также соотношение лейкоцитов к клеткам плоского эпителия более, чем 1:1; цервицита, является обнаружение более 10 лейкоцитов в поле зрения в отделяемом цервикального канала при просмотре более 5 полей зрения с помощью светового микроскопа при увеличении 1 х1000 и наличие выделений из цервикального канала слизи, гноя.
Условиями получения максимально точных результатов лабораторных исследований является:
- забор анализов для выявления Ureaplasma spp., M. hominis культуральными методами проводят не ранее, чем через 14 дней после окончания приема антибиотиков, методами амплификации ДНК (ПЦР, ПЦР – real-time) – не ранее, чем через месяц после окончания антибиотикотерапии;
- забор отделяемого из мочеиспускательного канала проводят не ранее, чем через 3 часа после последнего мочеиспускания, при наличии обильных выделений из уретры – через 15-20 минут после мочеиспускания;
- забор клинического материала из канала шейки матки и влагалища производят вне периода менструации;
- строгое соблюдение условий доставки образцов в лабораторию.
Другие методы лабораторных исследований, такие как метод прямой иммунофлюоресценции (ПИФ), иммуноферментного анализа (ИФА) для обнаружения антител к Ureaplasma spp. и/или M. hominis на данный момент массово не используют в связи с более низкой чувствительностью и специфичностью. Не используют биологические, химические и алиментарные провокации для повышения точности диагностики и при лечении урогенитальных болезней, вызванных Ureaplasma spp. и/или M. hominis.
Ведение беременных с болезнями, вызванными Ureaplasma spp. и/или M. hominis, и особенно M. genitalium, а также женщин с воспалительными заболеваниями органов малого таза (ВЗМТ) проводят акушеры-гинекологи.
Диагностику и лечение возможных осложнений микоуреаплазменной инфекции у мужчин на мочеполовую систему с нарушением репродуктивной функции проводят урологи-андрологи.
Лечение инфекций, вызванных M. Genitalium
При лечении урогенитальных болезней, вызванных M. genitalium, с неосложненным течением, рекомендуется назначать per os антибактериальные препараты:
- доксициклина моногидрат 100 мг 2 раза в сутки течение 10 дней.
- джозамицин 500 мг 3 раза в сутки в течение 10 дней.
- офлоксацин 400 мг 2 раза в сутки в течение 10 дней.
Для лечения урогенитальных болезней, вызванных M. genitalium, с осложненным течением, рекомендуется назначать per os антибактериальные препараты:
- доксициклина моногидрат 100 мг 2 раза в сутки течение 14-21 дней.
- джозамицин 500 мг 3 раза в сутки в течение 14-21 дней.
- офлоксацин 400 мг 2 раза в сутки в течение 14-21 дней.
Длительность курса лечения зависит от степени клинических проявлений воспалительных процессов мочеполовых органов, результатов лабораторных и инструментальных исследований; оценки степени риска предстоящих оперативных или инвазивных вмешательств, акушерско-гинекологического анамнеза, у беременных – течения настоящей беременности; выраженности ответа на проводимую антибактериальную терапию (клинические и лабораторно–микроскопические показатели, при необходимости – результат промежуточного теста ПЦР-real-time), и, при необходимости, может быть увеличена до 21 дня.
При отсутствии эффекта от лечения необходимо исключение реинфекции, повторное углубленное и неоднократное дообследование на ассоциированные ЗППП (трихомониаз, гонорею, хламидиоз) и назначение комплексного этапного лечения.
Беременным для лечения рекомендуется назначать джозамицин 500 мг 3 раза в сутки per os в течение 10 дней на любом сроке беременности врачами-акушерами-гинекологами.
Детям весом менее 45 кг назначают джозамицин 50 мг на кг массы тела в сутки per os, разделённые на 3 приема, в течение 10 дней. Детям весом более 45 кг проводится по схемам лечения для взрослых с учетом противопоказаний.
Лечение болезней, вызываемых Ureaplasma spp. и/или M. Hominis
При выявлении в анализах M. hominis и/или Ureaplasma spp. лечение проводится при наличии клинических, лабораторных признаков инфекционно-воспалительного процесса, при котором не выявлены другие, ассоциированные и более вероятные и чаще встречаемые его возбудители: C.trachomatis, N.gonorrhoeae, T.vaginalis, M. genitalium.
При выявление M.hominis и/или Ureaplasma spp. в количестве> 104 КОЕ (ГЭ)/мл(г), в отсутствии клинических и/или лабораторных признаков воспалительного процесса мочеполовой системы, лечение в настоящее время не назначается.
При отсутствии клинических и/или лабораторных признаков воспалительного процесса в мочеполовых органах, но при выявлении Ureaplasma spp. и/или M. hominis, лечение проводят только донорам спермы, лицам с диагнозом бесплодие и женщин с не вынашиванием беременности и перинатальными потерями в анамнезе, при отягощённом акушерском анамнезе. Им проводят лечение, направленное на уничтожение M.hominis и/или Ureaplasma spp., как потенциальных возбудителей воспалительных болезней органов мочеполовой системы.
Пациентам с урогенитальными болезнями, вызванными Ureaplasma spp. и/или M.hominis, назначают per os антибактериальные препараты:
- доксициклина моногидрат 100 мг 2 раза в сутки в течение 10 дней.
- джозамицин 500 мг 3 раза в сутки в течение 10 дней.
Длительность курса терапии зависит от степени клинических проявлений воспалительных процессов мочеполовых органов, результатов лабораторных и инструментальных исследований, оценки степени риска предстоящих оперативных или инвазивных вмешательств, акушерско-гинекологического анамнеза, у беременных — течения существующей на момент лечения беременности; выраженности ответа на проводимую антибактериальную терапию (клинические, лабораторно-микроскопические показатели, при необходимости – результат промежуточного теста ПЦР-real-time), и, при необходимости, может быть увеличена до 14 дней. Однако длительность лечения может существенно увеличиться при очень частой ассоциации генитальных микоплазм с возбудителями других ЗППП, таких как трихомониаз, гонорея, хламидиоз, протекающих, как правило, торпидно и выявляющихся в хронической стадии, после неоднократных обследований разными методами, при наличии уже осложнений на органы мочеполовой системы – в таких случаях (подавляющем большинстве) проводится комплексное этапное лечение. Беременным для лечения назначают джозамицин 500 мг 3 раза в сутки per os в течение 10 дней и на любом сроке беременности акушерами-гинекологами. Детям с весом тела менее 45 кг при лечении рекомендуется назначать джозамицин 50 мг на кг массы тела в сутки per os, разделённые на 3 приема, в течение 10 дней. Детям с весом тела более 45 кг проводится по схемам лечения для взрослых с учетом противопоказаний.
Профилактика и диспансерное наблюдение:
Профилактика инфекций, вызываемых M. genitalium:
- исключение случайных половых контактов;
- обязательное использование барьерных методов контрацепции и антисептиков
- обследование на ЗППП и лечение половых партнеров.
Установление излеченности инфекций, вызванной M. genitalium на основании методов амплификации РНК (NASBA) проводится через 14 дней после окончания лечения антибиотиками, на основании методов амплификации ДНК (ПЦР, ПЦР-real-time) – не ранее, чем через месяц после окончания антибиотикотерапии. Критериями излеченности являются положительная клиническая динамика, динамика лабораторно-микроскопических показателей, эрадикация (для M. genitalium) или снижение титра других генитальных микоуреаплазм. Пациенты с негативными результатами лабораторных анализов дальнейшему наблюдению и обследованию не подлежат.
- Установление излеченности заболеваний, вызванных Ureaplasma spp. и/или M.hominis, проводится на основании микроскопического исследования мазков из уретры, влагалища и цервикального канала у женщин и из уретры, секрета предстательной железы и спермы у мужчин (для оценки лабораторных признаков воспалительного процесса) и культурального метода исследования – через 14 дней после окончания лечения антибиотиками, на основании методов амплификации ДНК (ПЦР, ПЦР-real-time) – не ранее, чем через месяц после окончания лечения антибактериальными препаратами.
- Пациенты с неустановленными источниками инфицирования обследуются на сифилис через 3 месяца, на ВИЧ, гепатиты В и С - через 3-6-9 месяцев.
Хламидиоз
Урогенитальный хламидиоз - инфекция, передаваемая в большинстве случаев половым путём, возбудителем которой является Chlamydia trachomatis – грамм - отрицательная внутриклеточная бактерия, относящаяся к порядку Chlamydiales, семейству Chlamydiaceae, роду Chlamydia.
Серотипы C. trachomatis A, B, Ba, C являются возбудителями трахомы; D-K – урогенитального хламидиоза; L1, L2, L3 – венерической лимфогранулемы.
В организме человека хламидии находятся в двух формах, которые отличаются структурными и биологическими свойствами:
- высоко инфекционной - (спороподобной, внеклеточной, которая не размножается и не чувствительна к воздействию антибиотиков) формой - является элементарное тельце (ЭТ)
- вегетативной – (которая размножается, внутриклеточной, чувствительной к воздействию антибиотиков) формой – является ретикулярное тельце (РТ).
На начальном этапе после заражения происходит фиксация ЭТ на плазмолемме клетки хозяина с последующим проникновением хламидий в клетку эндоцитозом. В течение первых 7-10 часов происходит инвагинация участка плазмолеммы с адсорбированным ЭТ в цитоплазму с образованием фагоцитарной вакуоли, где в дальнейшем в течение 6-8 часов ЭТ превращается в вегетативную форму – РТ, способное к росту и дальнейшему размножению.
Размножение хламидий ведет к образованию особых включений (телец Гельберштедтера - Провачека). В первые 18-24 часов развития они в количестве от 100 до 500 хламидий локализуются в цитоплазматическом пузырьке, состоящим из мембраны клетки. В дальнейшем, в течение 36-42 часов происходит процесс созревания РТ через переходные (промежуточные тельца) (ПТ) и развитие ЭТ следующего поколения. Полный цикл репродукции хламидий длится 48-72 часа и завершается гибелью пораженной хламидиями клетки, однако, при неблагоприятных условиях метаболизма для жизнедеятельности хламидий, этот процесс может растянуться во времени. Размножение хламидий в эпителиальных клетках приводит к нарушению целостности эпителиального слоя, десквамации его, а также лимфоидной инфильтрации тканей.
Кроме того, хламидии обладают способностью подавлять механизм слияния фагосом с лизосомами, с последующим торможением роста хламидий в моноцитах и макрофагах в промежуточном состоянии на стадии между ЭТ и РТ и образованием так называемых «аберрантных» РТ, которые продуцируют минимальное количество структурных антигенов, но усиленно экспрессируют белок теплового шока хламидий – hsp-60, который обладает высокой сходностью с таким же белком мембраны клетки хозяина, в результате его иммунная и фагоцитарная система не способны распознать этот антиген как чужеродный, и поэтому антитела к нему могут также вызывать аутоиммунные поражения тканей, через усиление синтеза аутоантител, в т.ч антиспермальных, ведущих к иммунологическому бесплодию.
Устойчивость неразвивающихся РТ к противохламидийным антибиотикам связана с прекращением у них метаболических процессов, а также с переживанием возбудителем периода лекарственной терапии при их пребывании в особых мембранозащищенных зонах эпителия, трихомонадах, а также в нейтрофильных лейкоцитах, макрофагах, лимфоцитах, в эндотелиоцитах, лимфатических капиллярах и во внеклеточных фагосомах. Таким образом, персистирующая хламидийная инфекция является аутоиммунным процессом, способствующим поддержанию хронических воспалительных процессов, и не требующих в своем дальнейшем течении наличия микробного агента.
Хламидии поражают цилиндрический эпителий уретры, цервикального канала, конъюнктивы глаз и прямой кишки, изредка ротоглотки. У взрослых женщин хламидии не способны вегетировать в неизмененном многослойном плоском эпителии влагалища, в связи с высокой чувствительностью к кислой среде его содержимого, поэтому первичным очагом поражения, как правило, является слизистая оболочка шейки матки цервикального канала. В детском и подростковом возрасте хламидии, наоборот, могут вызывать поражение слизистых оболочек вульвы и влагалища. Этому способствуют анатомо-физиологические особенности репродуктивной системы девочек (не завершенность физиологических защитных механизмов, небольшое количество слоев поверхностного эпителия, щелочная PH вагинального отделяемого).
Хламидии также иногда поглощаются периферическими моноцитами и распространяются по всему организму, оседают в различных тканях, превращаются в тканевые макрофаги, которые могут сохранять жизнеспособность в течение нескольких месяцев, будучи при этом антигенным стимулятором, способствуя образованию фиброзных гранулем в здоровой ткани.
Инфицирование взрослых лиц хламидиозом происходит половым путем через контакт с больными хламидиозом, детей – перинатальным путем (антенатальным – через плаценту, интранатальным - в родах) и при половом контакте; реже, от больных матерей детям, чаще женского пола, еще реже девочки младшего возраста могут инфицироваться при нарушении правил личной гигиены и ухода за детьми (контактно - бытовой путь). Риск заражения женщин повышается при использовании оральных контрацептивов, в связи с потерей устойчивости клеток эпителия к этой инфекции из-за изменения гормонального фона, а также при абортах и других оперативных вмешательствах на органах мочеполовой системы. При ВИЧ инфекции люди более предрасположены к заражению хламидиозом, а урогенитальный хламидиоз, в свою очередь, увеличивает восприимчивость к инфицированию ВИЧ – 1, причем штаммы ВИЧ, выделенные от таких больных, более вирулентные.
Урогенитальный хламидиоз является очень распространенной ИППП. По оценкам ВОЗ, ежегодно 131 миллион человек инфицируется C. trachomatis, с наиболее высокой заболеваемостью у лиц моложе 30 лет. Хламидиоз в настоящее время занимает 2 место среди ИППП после трихомониаза, опережая гонорею и сифилис. Очень часто хламидиоз ассоциируется с другими ИППП и условно – патогенными микроорганизмами. Микст-инфекции, в свою очередь, увеличивают патогенность каждого входящего в ассоциацию микроорганизма, влияют на инкубационный период и клиническое течение воспалительного процесса (наиболее яркая клиника характерна для ассоциации с трихомониазом и гонореей), затрудняют их диагностику и особенно лечение, способствуют хронизации их и рецидивированию.
Хламидиоз как моноинфекция встречается чрезвычайно редко, только в 2%. У женщин с воспалительными заболеваниями мочеполовых органов ассоциация хламидий и гонореи достигает 30%, очень часты также ассоциации с трихомонадами, условно патогенной флорой (уреамикоплазмами, кандидами, гарднереллами, вирусными инфекциями (HSV, HPV), кишечной палочкой, стафилококками и энтерококками). Для микст-инфекции также характерна многоочаговость поражения (как урогенитальная, так и экстрагенитальная), сложности как с точной диагностикой, так и с последующим лечением.
Классификация заболеваний, вызванных наличием C. trachomatis
- Хламидиоз нижних отделов мочеполовой системы: уретрит, цервицит, цистит, вульвовагинит.
- Хламидиоз органов малого таза и других органов мочеполовой системы: парауретрит, эпидидимит, орхит, простатит, сопутствующий уретриту (у мужчин); вестибулит, сальпингоофорит, эндометрит, пельвиоперитонит (у женщин). а)Хламидиоз органов мочеполовой системы, точно не локализованный.
- Хламидиоз аноректальной области.
- Хламидийный фарингит, тубоотит, отит.
- Хламидиозы экстрагенитальной локализации (артрит, пневмония, перигепатит).
- Хламидийный конъюнктивит.
Хламидиоз нижних отделов мочеполовой системы
У женщин проявляется в виде:
- отечности и покраснения слизистой оболочки наружного отверстия уретры
- инфильтрации стенок уретры
- необильных выделений слизи и гноя из уретры
- отечности и покраснения слизистой оболочки шейки матки
- выделений слизи и гноя из цервикального канала
- эрозий и дисплазий слизистой оболочки шейки матки (в ассоциации с другими ИППП).
У мужчин:
- отечности и покраснение слизистой оболочки наружного отверстия уретры
- инфильтрации стенок уретры
- незначительных выделений слизи и гноя из уретры.
Хламидийный фарингит:
- У женщин и мужчин, в большинстве случаев отмечается клинически бессимптомное течение заболевания. При наличии клинических проявлений могут беспокоить субъективные симптомы: сухость в ротоглотке; боль, усиливающаяся при глотании; иногда сочетается с тубоотитом и отитом
- при осмотре - отечность и покраснение слизистой оболочки ротоглотки и миндалин
Хламидийный конъюнктивит- клинически протекает в виде простого или фолликулярного конъюнктивита в острой, подострой или хронических формах с жалобами на:
- сухость, светобоязнь, покраснение и отечность конъюнктивы пораженного глаза
- незначительную болезненность пораженного глаза
- незначительное отделяемое в виде слизи и гноя в углах поражённого глаза.
Хламидиоз органов малого таза и других органов мочеполовой системы
У женщин:
для более чем 70% женщин характерно бессимптомное течение заболевания. При наличии же клинических проявлений беспокоят субъективные симптомы:
- вестибулит (незначительное или умеренное выделение слизи и гноя из половых путей, покраснение наружных отверстий протоков вестибулярных желез, их болезненность и отечность)
- сальпингоофорит (для острого течения воспалительного процесса - характерна боль в области нижней части живота схваткообразного характера, выделения слизи и гноя из половых путей и цервикального канала; для хронического течения заболевания - клинические проявления менее выражены, характерно нарушение менструального цикла; при остром течении - увеличенные, болезненные при пальпации маточные трубы и яичники, укорочение сводов влагалища; при хроническом течении заболевания - незначительная болезненность, уплотнение маточных труб, ограниченная их подвижность при пальпации)
- эндометрит - боль в нижней части живота, как правило, тянущего характера (для острого течения заболевания характерна болезненная, увеличенная матка мягковатой консистенции, выделения слизи и гноя из цервикального канала; для хронического течения заболевания - субъективные проявления менее выражены, часто отмечаются пост- и межменструальные незначительные кровянистые выделения; при пальпации - плотная консистенция и ограниченная подвижность матки)
- пельвиоперитонит (характерный внешний вид – общее тяжелое состояние, гектическая температура тела, гипотензия, тошнота, рвота, олигурия, резкая болезненность живота при поверхностной пальпации, в нижних отделах определяется напряжение мышц брюшной стенки и положительный симптом раздражения брюшины, нарушения дефекации).
У мужчин:
- эпидидимоорхит (характерны: выделения слизи и гноя из мочеиспускательного канала; при пальпации определяются увеличенные, плотные и болезненные яичко и его придаток; болезненность в области придатка яичка и паховой области, чаще односторонняя; с иррадиацией в нижнюю часть живота, в область мошонки, на семенной канатик, паховый канал, область поясницы, крестца; наблюдается гиперемия и отек мошонки в области поражения)
- простатит, сопутствующий хроническому уретриту - боль в промежности и в нижней части живота с иррадиацией в область прямой кишки, дизурия (при пальпации определяется болезненная, уплотненная, иногда увеличенная и отечная предстательная железа).
У мужчин и женщин возможно поражение хламидиями парауретральных желез, с проявлениями в виде: зуда, жжения, болезненности при мочеиспускании (дизурии); с характерными выделениями слизи и гноя из мочеиспускательного канала; наличия плотных болезненных образований, размерами с просяное зерно, в области выводных протоков парауретральных желез; болей в области наружного отверстия уретры; болезненности во время половых контактов (диспареунии).
Клинические симптомы детского хламидиоза аналогичны клиническим симптомам у взрослых лиц, с более выраженной и яркой клинической симптоматикой поражения слизистых оболочек вульвы и влагалища у девочек.
Хламидийные ИППП, неполовой локализации
Для реактивного хламидийного артрита (болезни, синдрома Рейтера) характерно течение в виде уретроокулосиновиального синдрома, который классически проявляется в виде триады (полной или неполной): уретрита, конъюнктивита, артрита. Синдром Рейтера может также сопровождаться поражением кожи и слизистых оболочек (кератодермия, цирцинарный или ксеротический баланопостит, изъязвления слизистой оболочки полости рта), а также симптомами поражения внутренних органов (сердечно-сосудистой, нервной системы и почек). В 80-95% случаях болезнь Рейтера ассоциируется с антигеном HLA-B -27. Наличие общей антигенной детерминанты у возбудителей болезни Рейтера и антигенов HLA ведет к недостаточной элиминации микроорганизмов, возникновению латентной инфекции и формированию аутоиммунного процесса из-за перекрестного реагирования HLA-B-27 c hsp60 хламидий.
При реактивном артрите страдают следующие суставы: коленный, голеностопный, плюснефаланговый, пальцев стоп, тазобедренный, плечевой, локтевой и другие. Заболевание чаще протекает в виде полиартритов (в среднем поражается 5-6 суставов). Выделяют 2 стадии течения болезни Рейтера: инфекционно–токсическая (с лечебным эффектом от антихламидийных антибиотиков) и аутоиммунная (когда устранение инфекционного фактора существенно не влияет на течение болезни, при которой формируются персистирующие или рецидивирующие очаги иммунного воспаления в суставах или других органах). Средняя продолжительность первой стадии заболевания - 4-6 месяцев.
Для реактивного артрита характерно волнообразное течение: в 50% случаев через различные интервалы времени наблюдаются рецидивы заболевания. У 20% больных выявляются различные мышечные атрофии и энтезопатии, с наиболее частым поражением ахиллового сухожилия и плантарной фасции, что вызывает нарушения ходьбы.
При диссеминированном хламидиозе у мужчин и женщин могут развиться пневмония, перигепатит, перитонит.
Хламидиоз аноректальной области
У мужчин и женщин, отмечается, как правило, клинически бессимптомное течение заболевания. При наличии клинических проявлений характерны следующие клинические симптомы: при локальном поражении прямой кишки: зуд, жжение в аноректальной области, незначительные выделения из прямой кишки желтовато-розового цвета; при локализации процесса выше анального отверстия: болезненные тенезмы, болезненность при дефекации, слизисто-гнойные выделения из прямой кишки, нередко с примесью крови.
Лабораторная диагностика:
Диагноз хламидиоза устанавливается на основании результатов лабораторных исследований молекулярно-биологическими методами, направленными на обнаружение специфических фрагментов ДНК и/или РНК C. trachomatis (такими как ПЦР, ПЦР real-time или NASBA) в зависимости от локализации инфекционного процесса в организме, а также данных сексуального анамнеза: мазков со слизистой оболочки ротоглотки, отделяемого слизистой оболочки прямой кишки, слизистых оболочек женских половых органов, из уретры, спермы, секрета простаты, конъюнктивы, исследование первой порции мочи на C. trachomatis.
Обязательно обследование на хламидиоз при обнаружении других ИППП, (особенно после пролечивания часто сопутствующего ему трихомониаза и гонореи) и условно патогенной флоры (гарднереллеза, микоуреаплазмоза), вирусных (HSV, HPV), кандидоза, стафилококков и энтерококков, кишечной палочки, наличии эрозий или дисплазии шейки матки, воспалительных типов урогенитальных мазков, хронического простатита, бесплодия (как женского так и мужского или сочетанного), не вынашивания беременности в сроке до 12 недель (замершая или неразвивающаяся беременность), внематочной беременности в анамнезе, после незащищенного полового контакта.
Чувствительность молекулярно-биологических методов оценивается в 98-100%, специфичность - 100%. Строго необходимо соблюдение условий транспортировки клинического материала в лабораторию.
Ложноположительные результаты ПЦР являются следствием так называемой перекрестной контаминации продуктами амплификации. Ложноотрицательные результаты возникают вследствие присутствия в клиническом материале веществ, которые ингибируют ПЦР.
Более редко используются для диагностики хламидиоза такие методы как:
- культуральный- но из-за трудоемкости и длительности, проблемами с воспроизводимостью, необходимостью дорогостоящего оборудования, сред, инструментария, посуды, квалифицированного персонала – редко используется в рутинной клинической практике, а только лишь в научных исследованиях
- цитологический – но из-за низкой чувствительности, трудоемкости и высокой субъективности этот метод практически не используется
- иммуноферментный анализ (ИФА) – определение иммуноглобулинов классов: M, G, A.
- иммуноцитологический метод люминесцирующих антител: прямой (ПИФ), и непрямой иммунофлюоресцентный метод (НПИФ) – скрининговые методы. Ложноотрицательные результаты могут быть связаны с малым количеством или отсутствием эпителиальных клеток в мазке, а ложноположительные результаты – как следствие неспецифического связывания антител с неинфицированным материалом или другими видами Chlamydia, а также с недостаточной очисткой моноклональных антител – неспецифическое свечение.
- иммунохроматографический и ферментспецифический – косвенные (скрининговые) тесты лабораторной диагностики урогенитального хламидиоза.
Контроль излечимости:
- забор материала для контрольных исследований должен осуществляться не ранее, чем через месяц (для всех модификаций ПЦР) и через 14 дней (для NASBA) после окончания курса антибиотикотерапии препаратами активными в отношении C. trachomatis. На чувствительность исследования могут влиять различные ингибирующие факторы, вследствие чего предъявляются строгие требования к организации и режиму работы лаборатории для исключения контаминации клинического материала и минимизации, как ложноположительных, так и ложноотрицательных результатов.
Использование других методов лабораторных исследований, кроме молекулярно-биологических, таких как метод прямой иммунофлюоресценции (ПИФ), иммуноферментный анализ (ИФА) для обнаружения антител к C.trachomatis, микроскопический и морфологический методы для диагностики хламидиоза – в настоящее время не рекомендовано вследствие их более низкой чувствительности и специфичности чем ПЦР с большим количеством как ложноположительных, так и ложноотрицательных результатов.
Применение биологических, химических и алиментарных провокаций с целью повышения эффективности диагностики и при лечении хламидийной инфекции не рекомендуется.
Для исключения воспалительных заболеваний органов малого таза и осложненного течения хламидиоза рекомендуется проведение ультразвукового исследования органов малого таза (как трансабдоминально, так и трансавагинально и трансректально), а при необходимости и КТ или мпМРТ с контрастированием).
Рекомендуется консультация смежных врачей специалистов, таких как уролога, гинеколога, офтальмолога, оториноларинголога, проктолога, ревматолога, у детей – неонатолога, педиатра – с целью уточнения объема и характера дополнительного обследования.
Консервативное лечение
Рекомендовано для лечения хламидиоза нижнего отдела мочеполовой системы, аноректальной области, хламидийного фарингита, хламидийного конъюнктивита пероральное назначение трех групп антибиотиков :
- Макролидов: азитромицина, джозамицина, кларитромицина.
- Фторхинолонов: офлоксацина, левофлоксацина
- доксициклина
Длительность курса лечения строго индивидуально и зависит от степени клинических проявлений воспалительных процессов мочеполовых органов, результатов лабораторных и инструментальных исследований, наличия часто сопутствующих других ИППП. В зависимости от вышеперечисленных факторов длительность терапии может варьировать от 10-14 до 21 дня, при наличии болезни Рейтера от 4 до 7 недель. Важно отметить, что использование недостаточных для излечения доз препаратов может индуцировать образование персистентных форм и L- форм возбудителя хламидиоза.
Лечение беременных, больных хламидиозом, осуществляется на любом сроке беременности антибактериальными препаратами с учетом их влияния на плод при участии акушеров – гинекологов.
Лечение хламидиоза у детей с массой тела более 45 кг проводится в соответствии со схемами назначения у взрослых с учетом возможных противопоказаний.
Для лечения детей с массой тела до 45 кг рекомендуется назначать азитромицин per os, исходя из дозы 10 мг на кг массы тела длительностью не менее 7-10 дней.
Профилактика:
- исключение случайных половых контактов;
- использование средств барьерной контрацепции, тщательный туалет наружных половых органов с использованием антисептиков;
- обследование и лечение половых партнеров;
- обследование на другие ИППП;
- при неустановленном источнике инфицирования рекомендуется неоднократное обследование на сифилис через 3 месяца, на ВИЧ, гепатиты В и С – через 3-6-9 месяцев.
При отсутствии эффекта от лечения рекомендуется исключение как реинфекции, так и назначение препаратов другой фармакологической группы и лечения, с учетом часто сопутствующих других ИППП.
С Новым годом! ЗППП — не подарок. Праздники и секс
Новогодние и рождественские праздники — пора отдыха, приключений, беззаботности, зажигательных вечеринок, новых знакомств и романтических отношений с яркими эмоциями. Однако последствия праздничных сексуальных игр могут быть продолжительными и даже опасными для здоровья. Вместе с приятными воспоминаниями и «бабочками в животе» часто остаются инфекции (ЗППП). Чтобы узнать, как их определить и предотвратить, прочитайте до конца эту статью.
Что такое венерологические заболевания?
Это группа болезней, которые передаются половым путем:
- вагинальным,
- анальным,
- оральным.
Их вызывают:
- бактерии (гонорея, сифилис, хламидиоз, микоуреаплазмоз);
- простейшие - трихомониаз
- вирусы (ВИЛ, гепатитом, ВПЧ — вирус папилломы человека, HSV- вирус герпеса ½ типа);
- грибы (кандидоз),
- паразиты (лобковые вши, чесоточный клещ).
Признаки гонореи и других ЗППП
Симптомы кандидоза и паразитарных инфекций проявляются быстро и относительно легко поддаются лечению. Сифилис, гонорея, трихомониаз или вирусы могут протекать бессимптомно в течение длительного времени. Если их не лечить, могут привести:
- к повреждению костей и суставов (гонорея, хламидия)
- сбоям в системе кровообращения (третичный сифилис)
- психическим расстройствам (третичный сифилис)
Инфицированные люди часто не подозревают, что они являются носителями, поэтому не лечатся и представляют потенциальную опасность для окружающих.
Нелеченная вирусная инфекция приводит к развитию таких серьезных заболеваний, как:
- ВИЧ к СПИДУ
- гепатит В и С к циррозу и первичному раку печени
- ВПЧ к раку шейки матки у женщин и полового члена у мужчин
- Трихомониаз, гонорея, хламилия к бесплодию, лечение которого очень долгое и дорогостоящее и не всегда эффективное.
Если у человека гонорея, или трихомониаз, симптомы следующие:
- боль, зуд, жжение, мутные выделения из половых органов с неприятным запахом, гнойные выделения из уретры;
- дискомфорт при мочеиспускании или значительное учащение его частоты;
- папилломы (или бородавки) при ПВЧ
- Эрозии или язвы на гениталиях при первичном сифилисе
5 правил защиты от венерических заболеваний в новогодние праздники
-
Самый простой и эффективный способ защиты от ЗППП — это неповрежденный и правильно примененный презерватив. Он предотвращает заражение во время всех видов полового акта как у гетеросексуальных, так и у гомосексуальных пар.
-
Существуют специальные маски для полости рта из силикона или полиуретана, которые создают барьер между ртом и влагалищем или анусом. Они не уменьшают ощущения и должны применяться особенно во время менструации, когда может произойти контакт с кровью.
-
Использование лубрикантов (увлажняющих гелей на водной или силиконовой основе) вместе с презервативом. Они снижают болевые ощущения, вероятность появления ссадин, язв или кожных поражений заднего прохода, то есть возможность передачи ЗППП.
-
Гигиена интимных мест до и после каждого полового акта при помощи специальных жидкостей и салфеток.
-
Не допускайте тесного контакта половых органов с эротическими аксессуарами (вибратором), влажным полотенцем, губкой или другими предметами, контактирующих с физиологическими жидкостями другого, часто инфицированного человека. Некоторые ЗППП, такие как ВИЧ или гепатиты В и С, передаются через контакт с зараженной кровью.
Но самый действенный метод предотвращения возникновения венерических заболеваний — верность. Наличие постоянного и верного полового партнера, отказ от случайных связей значительно снижает риск заражения ЗППП.
Когда нужна консультация венеролога онлайн?
При подозрении на ВИЧ, гепатит и ВПЧ тестирование следует проводить через 6–12 недель после рискованного полового акта. Это период инкубации вируса, когда организм начинает вырабатывать антитела. Слишком раннее выполнение теста может привести к отрицательному результату и усыпить бдительность.
Грибковые и паразитарные инфекции можно определить на основании взятого мазка и визуального осмотра врачом. В случае появления вышеперечисленных тревожных симптомов сначала необходима консультация уролога-венеролога онлайн. Он назначит анализы на наличие трихомониаза, гонореи, сифилиса и вирусных заболеваний и пропишет специальные препараты.
Раннее выявление инфекции и ее быстрое лечение дают больше шансов на выздоровление.
При лечении используются:
- бактериальных инфекций (сифилиса или гонореи) — антибиотики, чаще всего в виде инъекций (Penicillinum Procainicum L TZF, Penicillinum Crystallisatum TZF); цефалоспорины, тетрациклины или аминогликозиды
- трихомониаз – производные азолов (метрогидазол, орнидазол, ниморазол, сатронидазол и др.)
- паразитов (чесотки, лобковых вшей) - местные рецептурные химиотерапевтические средства;
- местных дрожжевых грибков (кандидоза) — пессарии, вагинальные капсулы, свечи с клотримазолом, омоконазолом, гинекологические пробиотики. В более тяжелых случаях необходим прием пероральных противогрибковых препаратов.
Вирусные инфекции лечить гораздо сложнее. ВИЧ-инфекция неизлечима по сей день, но есть лекарства, задерживающие развитие этой болезни.
Хелп — ЦИСТИТ! Нужен хороший уролог!
В нормальных физиологических условиях мочевыводящие пути у человека стерильны, то есть в них нет микроорганизмов. Наиболее частая инфекция мочеполовой системы — это цистит. Почему при ней срочно необходима консультация уролога, вы узнаете из этой статьи.
Воспаление мочеполовой системы: кто в зоне риска
Заболеваемость инфекциями мочевыводящих путей зависит от возраста и пола. В младенчестве ею чаще страдают мальчики, что является следствием более частого возникновения пороков развития мочевыделительной системы.
После 1 года ситуация меняется. У девочек чаще всего заражение происходит через уретру. Из-за небольшого расстояния между отверстием уретры и преддвериями влагалища и прямой кишки бактериям легче проникать в мочевой пузырь.
Вероятность возникновения инфекций значительно увеличивается с началом половой жизни и до 50 раз чаще бывает у женщин, чем у мужчин.
После 60 лет из-за гиперплазии простаты и застоя мочи заболеваемость мужчин возрастает, но все равно в два раза чаще страдают этим заболеванием женщины.
Основные причины цистита
Наиболее частая причина цистита — бактериальная инфекция.
Присутствие микробов в мочевыводящих путях над сфинктером мочевого пузыря вызывает воспаление.
Перенос бактерий Escherichia coli происходит:
- из-за небольшого расстояния между анусом и отверстием уретры;
- при половом акте;
- при неправильной интимной гигиене;
- раздражении вокруг уретры из-за использования ароматизированного мыла или других средств для ванн или интимных дезодорантов;
- применения тампонов, средств вагинальной контрацепции и некоторых медицинских средств, таких как циклофосфамид, используемых в химиотерапии;
- лучевая терапия области малого таза;
- длительное использование катетера;
- неполное опорожнение мочевого пузыря: у женщин из-за беременности и послеродовом периоде; у мужчин — из-за увеличенной простаты в связи с аденомой или раком;
- менопауза: у женщин — изменение состава физиологической бактериальной флоры после прекращения гормональной активности яичников, у мужчин с возрастом наблюдается снижение антимикробной активности секрета предстательной железы;
- осложнения других заболеваний (мочекаменной болезни (камней) в мочевом пузыре и почках, диабета, травм спинного мозга, инсультов.
Когда нужен врач-уролог онлайн?
Детям и мужчинам следует обращаться к врачу при каждом проявлении цистита.
Женщинам — при повторяющихся симптомах — 3 и более раз в год (хронический цистит). Обязательно — при беременности.
Тревожные симптомы цистита
У детей
- боль, жжение или покалывание при мочеиспускании
- позывы к мочеиспусканию и дискомфорт внизу живота
- частое мочеиспускание очень маленькими порциями
- темная мутная моча с измененным запахом
У взрослых
- увеличение частоты мочеиспускания
- боль при мочеиспускании
- частые позывы к мочеиспусканию
- мутная моча и измененный запах мочи
- дискомфорт внизу живота
Независимо от пола и возраста обратитесь к врачу, если у вас возникли при диагностированном цистите:
- боль в пояснице, над лобком
- тошнота и рвота, слабость
- кровь в моче (гематурия)
- в целом плохое самочувствие, общее недомогание
- субфебрильная температура или лихорадка с ознобом.
Эти симптомы могут указывать на осложнение цистита пиелонефритом
Наиболее уязвимы к осложнениям цистита маленькие дети и пожилые люди из-за возможности упустить из виду симптомы цистита или спутать их с другими заболеваниями.
Что будет, если не лечить цистит:
(прогноз и осложнения)
У 10–20% женщин симптомы повторяются в течение 2 недель после прекращения лечения цистита. Они вызваны тем же организмом, который пережил лечение, или другим возбудителем, ранее не найденным при обследовании, или находящемся в скрытой форме, в другом месте (в анусе или во влагалище), или при обследовании полового партнера.
При правильном и своевременном лечении практически не возникает осложнений.
Однако если не лечить цистит, он может привести к:
- пиелонефриту, восходящему рефлюксу, карбункулу и абсцессу почки, сепсису
- мочекаменной болезни
- раздражению промежности
Консультация уролога онлайн или осмотр венеролога в Киеве. Что лучше выбрать?
Уролог, андролог, венеролог?
К какому врачу обратиться, если вы обнаружили у себя признаки ЗППП? Что лучше — онлайн-консультация или осмотр венеролога в клинике? Ответы на эти и другие вопросы вы получите, прочитав эту статью.
Когда нужен хороший уролог?
Если финансовое положение и время не позволяют посетить клинику, то поможет уролог онлайн.
Уролог — это врач, который занимается диагностикой и лечением заболеваний мочеполовой системы (воспаления головки полового члена, крайней плоти, уретры, варикоцеле, водянки и опухолей яичек, почек, предстательной железы и мочевого пузыря. После беседы с пациентом и установкой предварительного диагноза он направит на анализ ИППП, общий анализ мочи, крови, спермограмму, гормональный профиль, онкомаркеры, узи, мрт, кт и к другим специалистам.
Чем занимается врач-андролог?
Андролог — мужской эквивалент гинеколога. Он занимается диагностикой и лечением мужских половых органов — яичек, придатков яичка, полового члена, предстательной железы и семенных пузырьков.
Помогает решить такие проблемы репродуктивной системы у мужчин, как бесплодие и эректильная дисфункция (импотенция), которые часто являются следствием не диагностированных и не леченных ЗППП. Как гинеколог во время менопаузы, андролог помогает мужчинам пройти через андропаузу, и быть как мужчина, «на высоте». Она хотя и мягче, чем менопауза у женщин, но может подвергнуть пациента определенному риску для здоровья и снизить качество его жизни, причем не только сексуальной.
Когда необходимо обратиться к андрологу:
- проблемы с эрекцией;
- сухая (ретроградная) эякуляция;
- нарушения фертильности;
- андропауза (мужской климакс);
- появление видимых отклонений в строении репродуктивной системы;
- боль или припухлость в области гениталий и промежности
- появление тревожных изменений на половом члене, яичках или мошонке (уплотнения, утолщения и тд.);
- резкое снижение либидо (это также может быть связано с плохим гормональным балансом, за который отвечает репродуктивная система).
Что делает врач - венеролог онлайн?
Врач, который специализируется на диагностике и лечении венерических заболеваний, называется «венеролог». Он определяет подозрение на инфекции ЗППП, назначает анализы ИППП, соответствующее лечение, подробно объясняет пациенту, как могло возникнуть заражение, и как правильно осуществляется профилактика ЗППП и обострений хронического уретрита и уретропростатита.
Зачем нужно посещение венеролога в Киеве?
О посещении этого врача существует много мифов и шуток, особенно о неприятном осмотре.
В случае с андрологом первое посещение заключается в тщательном изучении истории болезни, сбора анамнеза и обсуждении проблем — жалоб на симптомы, которые волнуют пациента. Это можно сделать онлайн, тогда определить необходимость посещения в клинику.
Во время этого визита врач осматривает гениталии мужчины, а также может осуществить ректальный осмотр, если видит основания для проверки состояния простаты. Далее врач, при необходимости, направляет на дополнительные анализы, которые помогут определить источник проблем репродуктивной системы:
- общий анализ мочи;
- развернутый анализ крови;
- спермограмму и посев спермы на трихомониаз и гонорейную инфекцию
- проводит взятие мазков из уретры, секрета простаты, пцр тестов и бакпосевов на флору
- проводит УЗИ органов мочеполовой системы
- гормональные тесты (уровень важных для мужского организма гормонов — начиная с тестостерона);
- проверку уровня холестерина и сахара (слишком высокий их уровень может сказаться на работе всего организма, включая репродуктивную систему).
При возникновении подозрения на новообразования (доброкачественного или злокачественного, т.е. рака) врач может назначить:
- высокоточные гормональные тесты, тесты на маркеры рака простаты (PSA и др.);
- МРТ, КТ органов мочеполовой системы, ПЭТ КТ, радиоизотопное обследование;
- Биопсию органов мочеполовой системы, включая фьюжн-биопсию.
Это распространенные общие обследования, которые помогают увидеть полную картину здоровья пациента. На основании этих данных врач может начать лечение или направить больного к другим специалистам.
После консультации с урологом-андрологом может потребоваться помощь:
- онкоуролога (когда симптомы или результаты указывают на рак органов мочеполовой системы),
- сосудистого хирурга (при проблемах с кровообращением в кавернозных телах полового члена),
- сексолог (например, в случае психогенной импотенции) и др.
Мужское бесплодие: мифы и реальность
Проблема бездетности затрагивает примерно 15–20% супружеских пар и до 15% мужчин в мире. Несмотря на свободный доступ к информации, в обществе по-прежнему существует убеждение, особенно среди мужчин, что от бесплодия страдают в основном женщины. Однако ученые доказали, что 50% случаев трудностей с зачатием ребенка именно в мужчине кроется причина.
Мужское бесплодие VS Женское бесплодие
Каждый мужчина на каком-то этапе жизни желает стать отцом ребенка и определяет неспособность оплодотворить женщину как личную неудачу. Ему труднее принять такую информацию, и он склонен обвинять в этом других людей. У него падает самооценка, возникает апатия, отчуждение и даже агрессия к родственникам. Согласно наблюдениям медицинских клиник по всему миру, чаще всего бесплодие лечится только у женщин. Мужчины категорически отказываются признать, что это их проблема. О сексуальных проблемах мужчин, как в СМИ, так и в социуме, говорят менее охотно, чем о женских. Поэтому пострадавшие мужчины чувствуют себя изолированными и начинают стыдиться.
В соответствии с определением Всемирной организации здравоохранения (ВОЗ), признаки бесплодия у пары диагностируются после невозможности женщины забеременеть после года регулярных половых контактов со средней частотой 3–4 половых контакта в неделю без использования контрацептивов. По разным данным, это происходит в каждом 5–6-ом браке в мире.
Исследования ученых, изучавших мужское бесплодие, причины и излечение, показывают, что за последние 10 лет количество сперматозоидов с нормальной подвижностью и структурой значительно уменьшилось, а количество сперматозоидов, которые не могут оплодотворить женскую яйцеклетку, возросло. Это связано со многими факторами, наиболее распространенными из которых являются:
- системные заболевания:
- сердечно-сосудистые болезни;
- сахарный диабет;
- заболевание щитовидной железы;
- болезни печени;
- гиперпролактинемии;
- хронический нефрит;
- воспаление предстательной железы;
- ретроградная эякуляция;
- гипоспадия;
- заболевания яичек:
- генетические нарушения;
- рак яичек;
- варикозное расширение вен семенного канатика;
- яичко гидроцеле;
- идиопатический гипотиреоз;
- повреждение яичек при вирусных заболеваниях;
- травмы яичек;
- нарушения в развитии сперматозоидов:
- отсутствие или аномальная подвижность сперматозоидов;
- нарушения в структуре спермы;
- снижение количества сперматозоидов в сперме
- анатомические и структурные нарушения сперматозоидов, которые препятствуют попаданию их в сперму;
- дополнительные факторы:
- инфекции органов малого таза;
- окружающая среда;
- возраст старше 40 лет;
- хронический стресс;
- избыточный вес;
- чрезмерное употребление алкоголя;
- курение;
- злоупотребление наркотиками;
- плохие условия труда (окружение токсичными химикатами).
Как осуществляется диагностика бесплодия у мужчин?
Основным элементом диагностики мужского бесплодия является анализ спермы, который включает:
- базовую диагностику, которая определяет физические и химические параметры спермы: концентрацию, подвижность, морфологию и жизнеспособность сперматозоидов;
- тест MAR на наличие антител на поверхности сперматозоидов, что может снижать их подвижность и жизнеспособность, а также затруднять прохождение сперматозоидов через цервикальную слизь, препятствуя оплодотворению;
- тест SCD — исследование структуры хроматина сперматозоидов для оценки степени повреждения ДНК сперматозоидов. Поврежденная ДНК сперматозоидов снижает шансы на оплодотворение. Это также вызывает аномалии на ранней стадии развития эмбриона и увеличивает риск передачи генетических дефектов ребенку и выкидыша;
- посев спермы для выявления бактерий и грибков в сперме.
При необходимости врач может порекомендовать дальнейшую диагностику, в том числе:
- физикальное обследование путем осмотра полового члена, яичек и мошонки. Оно проводится, чтобы определить, есть ли у мужчины какие-либо анатомические аномалии, которые могут снизить фертильность;
- УЗИ помогает обнаруживать варикозное расширение вен семенного канатика,
- гормональные тесты;
- генетические и иммунологическое исследования.
3 самых распространенных мифа о лечении мужского бесплодия
МИФ 1. Из-за отклонений в параметрах спермы у меня никогда не будет детей?
Не при всех отклонениях в анализе спермы мужчине назначают пройти комплексное и длительное лечение бесплодия.
Общие рекомендации заключаются в отказе от алкоголя, кофеина, курения, в регулярной физической активности, заботе о правильной массе тела, диете с низким содержанием жиров и высоким содержанием белка, богатой цельнозерновыми, фруктами и овощами, селеном и цинком, которые необходимы для правильного созревания спермы. Достаточное количество цинка в рационе помогает достичь сексуальной активности и фертильности, обеспечение организма достаточным количеством витамина С, который улучшает всасывание ценных соединений в ЖКТ и увеличивает жизнеспособность и выживаемость сперматозоидов. Витамин С также защищает ДНК сперматозоидов от повреждения свободными радикалами. Прием витамина Е способствует улучшению фертильности у мужчин.
МИФ 2. Если я не вижу явных проблем с моей сексуальной жизнью, мне не нужно идти к специалисту?
Подавляющее большинство заболеваний, вызывающих мужское бесплодие, протекают бессимптомно. В 20% случаев невозможно точно определить причину проблем с фертильностью и степени бесплодия. Тогда оно называется «идиопатическое». Это не вызвано конкретным заболеванием или расстройством. Напротив, результаты теста не показывают отклонений, которые могли бы указывать на проблемы с зачатием ребенка. В этом случае специалисты сосредотачиваются на решении проблемы, а не на поиске причины. Если идиопатическое бесплодие длится более 2–3 лет, рекомендуется использовать вспомогательные репродуктивные технологии (инсеминация, in vitro).
МИФ 3. У меня начались проблемы с эрекцией. Значит ли это, что я больше никогда не смогу удовлетворить свою партнершу?
Проблемы с эрекцией или эякуляцией часто являются временным явлением, возникающим в результате стрессового образа жизни, неправильного питания, злоупотребления алкоголем или сигаретами, недостатка сна.