M. Babjuk (председатель), M. Burger (вице-председатель), E. Compérat,
P. Gontero, A.H. Mostafid, J. Palou, B.W.G. van Rhijn, M. Rouprêt,
S.F. Shariat, R. Sylvester, R. Zigeuner
Помощники в составлении рекомендаций: O. Capoun, D. Cohen,
J.L. Dominguez Escrig, V. Hernández, B. Peyronnet, T. Seisen, V. Soukup
Перевод: К.А. Ширанов
Научное редактирование:
А.Д. Каприн, Б.Я. Алексеев, А.С. Калпинский
© Европейская ассоциация урологов, 2020
СОДЕРЖАНИЕ
- 1. Введение
- 1.1. Цели и задачи
- 1.2. Состав рабочей группы
- 1.3. Доступные публикации
- 1.4. История публикаций и резюме по изменениям
- 1.4.1. История публикаций
- 1.4.2. Резюме по изменениям
- 2. Методы
- 2.1. Поиск данных
- 2.2. Рецензирование
- 2.3. Будущие цели
- 3. Эпидемиология, этиология и патогенез
- 3.1. Эпидемиология
- 3.2. Этиология
- 3.3. Гистологические типы
- 3.4. Резюме по данным литературы по эпидемиологии, этиологии и патогенезу
- 4. Стадирование и классификация
- 4.1. Определение неинвазивного рака мочевого пузыря
- 4.2. Классификация TNM
- 4.3. Подразделение стадии T1
- 4.4. Гистологическая градация неинвазивного переходно-клеточного рака мочевого пузыря
- 4.5. Карцинома in situ и ее классификация
- 4.6. Вариабельность определения стадии и степени злокачественности между одним и разными исследователями
- 4.7. Другие перспективные морфологические параметры
- 4.8. Молекулярная классификация
- 4.9. Резюме по данным литературы и рекомендации по классификации рака мочевого пузыря
- 5. Диагностика
- 5.1. Анамнез пациента
- 5.2. Признаки и симптомы
- 5.3. Физикальное исследование
- 5.4. Методы визуализации
- 5.4.1. Компьютерная томография и экскреторная урография
- 5.4.2. Ультразвуковое исследование
- 5.4.3. Мультипараметрическая магнитно-резонансная томография
- 5.5. Цитологическое исследование мочи
- 5.6. Исследование молекулярных маркеров в моче
- 5.7. Практическое применение цитологического исследования мочи и маркеров
- 5.7.1. Массовое обследование популяции, имеющей риск развития РМП
- 5.7.2. Обследование пациентов с гематурией или другими симптомами, позволяющими заподозрить наличие РМП (первичное выявление)
- 5.7.3. Наблюдение неинвазивного рака мочевого пузыря
- 5.7.3.1. Наблюдение пациентов с неинвазивным раком мочевого пузыря высокого риска
- 5.7.3.2. Наблюдение пациентов с неинвазивным раком мочевого пузыря низкого и промежуточного риска
- 5.8. Цистоскопия
- 5.9. Резюме по данным литературы и рекомендации по первичной диагностике неинвазивного рака мочевого пузыря
- 5.10. Трансуретральная резекция опухолей мочевого пузыря стадии Ta, T1
- 5.10.1. Стратегия операции
- 5.10.2. Хирургические и технические аспекты резекции опухоли
- 5.10.2.1. Хирургическая стратегия резекции (резекция по частям, en-bloc резекция)
- 5.10.2.2. Оценка качества резекции
- 5.10.2.3. Монополярная и биполярная резекция
- 5.10.2.4. Амбулаторная фульгурация и лазерная вапоризация
- 5.10.2.5. Резекция небольших папиллярных опухолей мочевого пузыря во время трансуретральной резекции предстательной железы
- 5.10.3. Биопсия мочевого пузыря
- 5.10.4. Биопсия простатического отдела уретры
- 5.11. Новые методы визуализации опухоли
- 5.11.1. Фотодинамическая диагностика (флуоресцентная цистоскопия)
- 5.11.2. Узкополосная визуализация
- 5.11.3. Дополнительные технологии
- 5.12. Повторная резекция
- 5.12.1. Выявление резидуальных образований и повышение стадии опухоли
- 5.12.2. Влияние повторной резекции на результаты лечения
- 5.12.3. Время выполнения повторной резекции
- 5.12.4. Запись результатов
- 5.13. Морфологическое заключение
- 5.14. Резюме по данным литературы и рекомендации по ТУР мочевого пузыря и протоколу патоморфологического исследования
- 6. Прогнозирование рецидива и прогрессирования рака мочевого пузыря
- 6.1. Опухоли стадии Ta, T1
- 6.2. Карцинома in situ
- 6.3. Стратификация пациентов по группам риска
- 6.4. Подгруппа опухолей самого высокого риска
- 6.5. Резюме по данным литературы и рекомендации по стратификации неинвазивного рака мочевого пузыря
- 7. Лечение
- 7.1. Рекомендации по прекращению курения
- 7.2. Адъювантная терапия
- 7.2.1. Внутрипузырная химиотерапия
- 7.2.1.1. Однократная немедленная послеоперационная внутрипузырная химиотерапия
- 7.2.1.2. Дополнительная адъювантная внутрипузырная химиотерапия
- 7.2.1.3. Оптимизация эффективности внутрипузырной химиотерапии
- 7.2.1.4. Резюме по данным литературы – внутрипузырная химиотерапия
- 7.2.2. Внутрипузырная БЦЖ-иммунотерапия
- 7.2.2.1. Эффективность БЦЖ-терапии
- 7.2.2.2. Штаммы БЦЖ
- 7.2.2.3. Токсичность БЦЖ-терапии
- 7.2.2.4. Оптимальный режим БЦЖ-терапии
- 7.2.2.5. Оптимальная доза БЦЖ-терапии
- 7.2.2.6. Показания к БЦЖ-терапии
- 7.2.2.7. Резюме по данным литературы – БЦЖ-терапия
- 7.2.3. Комбинированная терапия
- 7.2.3.1. Комбинация внутрипузырной БЦЖ-терапии и химиотерапии по сравнению с БЦЖ-терапией в режиме монотерапии
- 7.2.3.2. Комбинированная терапия с применением интерферона
- 7.2.4. Особенности лечения карциномы in situ
- 7.2.4.1. Тактика лечения
- 7.2.4.2. Когортные исследования внутрипузырной БЦЖ-терапии или химиотерапии
- 7.2.4.3. Проспективные рандомизированные исследования внутрипузырной БЦЖ-терапии или химиотерапии
- 7.2.4.4. Лечение внепузырной карциномы in situ
- 7.2.4.5. Резюме по данным литературы – лечение карциномы in situ
- 7.3. Лечение при неэффективности внутрипузырной терапии
- 7.3.1. Неэффективность внутрипузырной терапии
- 7.3.2. Рецидивы и неэффективность внутрипузырной БЦЖ-терапии
- 7.3.3. Лечение при неэффективности БЦЖ-терапии и рецидива после БЦЖ-терапии
- 7.3.4. Резюме по данным литературы – лечение при внутрипузырном рецидиве
- 7.4. Радикальная цистэктомия при неинвазивном раке мочевого пузыря
- 7.5. Рекомендации по адъювантной терапии опухолей стадии Ta, T1 и карциномы in situ
- 7.6. Рекомендации по лечению опухолей стадии Ta, T1 и карциномы in situ в зависимости от группы риска
- 7.7. Рекомендации по лечению больных с неэффективностью БЦЖ-терапии
- 7.2.1. Внутрипузырная химиотерапия
- 8. Наблюдение за пациентами с неинвазивным раком мочевого пузыря
- 8.1. Резюме по данным литературы и рекомендации по наблюдению пациентов с неинвазивным раком мочевого пузыря
- 9. Литература (представлена в конце издания)
- 10. Конфликт интересов
- 11. Информация по цитированию
1. Введение
1.1. Цели и задачи
Данный обзор представляет собой обновленные рекомендации Европейской ассоциации урологов (ЕАУ) по неинвазивному раку мочевого пузыря (НИРМП): опухолям стадии Ta, T1 и карциноме in situ. Если не указано иное, вся информация относится к переходно-клеточному раку. Цель
рекомендаций заключается в том, чтобы дать практические рекомендации по клиническому лечению НИРМП, уделяя особое внимание клиническим проявлениям и тактике ведения.
Кроме того, опубликованы отдельные документы ЕАУ с рекомендациями по опухолям верхних мочевыводящих путей [1], инвазивному раку мочевого пузыря (ИРМП) [2] и первичному раку уретры [3]. Необходимо подчеркнуть, что клинические рекомендации включают наиболее качественные данные, доступные в настоящее время экспертам. Однако следование рекомендациям не всегда приведет к оптимальному результату. Клинические рекомендации никогда не заменят клинический опыт при определении тактики лечения конкретного пациента, а скорее помогут направить ее с учетом персональных данных и предпочтений/конкретной ситуации больного. Рекомендации не являются обязательными для соблюдения и не рассматриваются как юридический стандарт оказания помощи.
1.2. Состав рабочей группы
Рабочая группа ЕАУ по НИРМП состоит из международной многопрофильной команды экспертов, включая уролога, онкоуролога, морфолога и статистика. Члены рабочей группы выбраны на основании их опыта, чтобы представлять специалистов, занимающихся лечением пациентов с подозрением на рак мочевого пузыря (РМП). Все эксперты, которые принимали участие в создании документа, направили заявление о возможном конфликте интересов, которое можно посмотреть на сайте ЕАУ: https://uroweb.org/guideline/non-muscle-invasive-bladder-cancer/.
1.3. Доступные публикации
Доступны краткие рекомендации как в печатном виде, так и в различных версиях для мобильных устройств на базе iOS и Android, в которых представлены основные данные из рекомендаций по НИРМП. Это сокращенные версии, которые требуют обращения к полному тексту рекомендаций. Опубликован ряд научных статей, последняя из которых датируется 2016 г. [4], а также несколько переводов всех версий рекомендаций. Все документы доступны на сайте ЕАУ: https://uroweb.org/guideline/non-muscle-invasive-bladder-cancer/.
1.4. История публикаций и резюме по изменениям
1.4.1. История публикаций
Первые рекомендации ЕАУ по раку мочевого пузыря были опубликованы в 2000 г. Настоящее печатное издание представляет собой ограниченное обновление рекомендаций 2019 г.
1.4.2. Резюме по изменениям
Во все разделы включены дополнительные данные. В следующих разделах сделаны наибольшие изменения:
- 4.7 «Редкие гистологические варианты и лимфососудистая инвазия»: раздел расширен,
включена дополнительная информация по редким гистологическим вариантам; - 7.3 «Лечение при неэффективности внутрипузырной терапии»: раздел значительно расширен,
пересмотрены рис. 7.2, табл. 7.2 «Категории неэффективности внутрипузырной БЦЖ-терапии»
и раздел 7.7 «Рекомендации по лечению больных с неэффективностью БЦЖ-терапии».
В следующих разделах изменены рекомендации:
7.5. Рекомендации по адъювантной терапии опухолей стадии Ta, T1 и карциномы in situ
|
Рекомендации |
СР |
|---|---|
|
При отсутствии ответа на БЦЖ-терапию показана радикальная цистэктомия (см. раздел 7.7) |
Сильная |
|
При отсутствии ответа на БЦЖ-терапию и противопоказаниях к радикальной цистэктомии (вследствие сопутствующих заболеваний) рекомендуется стратегия сохранения мочевого пузыря (внутрипузырная химиотерапия, внутрипузырная химиотерапия с микроволновой гипертермией, внутрипузырная химиотерапия с использованием EDMA, внутрипузырная или системная иммунотерапия, предпочтительно в рамках клинических исследований) |
Слабая |
7.7. Рекомендации по лечению больных с неэффективностью БЦЖ-терапии
|
Категория |
Рекомендации по лечению |
СР |
|---|---|---|
|
Отсутствие ответа на БЦЖ-терапию |
1. Радикальная цистэктомия |
Сильная |
|
2. Включение в клинические исследования по оценке новых стратегий лечения |
Слабая |
|
|
3. Стратегии сохранения мочевого пузыря у пациентов, которые не подходят или отказываются от цистэктомии |
Слабая |
|
|
Рецидив опухоли стадии T1-Ta/высокой степени злокачественности в срок более 6 месяцев или карцинома in situ в срок более года после завершения БЦЖ-терапии |
1. Радикальная цистэктомия или повторный курс БЦЖ-терапии в зависимости от индивидуальной ситуации |
Сильная |
|
2. Стратегии сохранения мочевого пузыря |
Слабая |
|
|
Рецидив после БЦЖ-терапии низкой степени злокачественности после лечения первичной опухоли промежуточного риска |
1. Повторный курс БЦЖ-терапии или химиотерапии |
Слабая |
|
2. Радикальная цистэктомия |
Слабая |
2. Методы
2.1. Поиск данных
В клинических рекомендациях 2019 г. по НИРМП посредством структурированного литературного поиска найдены, сопоставлены и оценены новые и клинически значимые данные.
Рабочая группа провела обширный поиск литературы, охватывающий все аспекты рекомендаций по НИРМП. Из полученных статей исключены базовые исследования, серии случаев, отчеты и комментарии редакторов. Включены только исследования взрослых пациентов, результаты которых опубликованы на английском языке. Кроме того, поиск был ограничен с 8 июня 2018 г. по 16 мая 2019 г. Поиск проводился в базе данных Pubmed, Ovid, EMBASE и центральном реестре и базе Кокрейновских систематических обзоров. После дедубликации найдены и проанализированы 1124 статьи.
В настоящие рекомендации всего включена 31 новая публикация. Поисковая стратегия представлена по адресу: https://uroweb.org/guideline/non-muscle-invasive-bladder-cancer/?type=appendices-publications.
В разделах 3–6 («Эпидемиология, этиология и патогенез», «Стадирование и классификация», «Диагностика и прогноз») литература оценивалась по уровню доказательности (УД), а рекомендации градировали по степени (СР) согласно системе, модифицированной из классификации Оксфордского центра медицинских исследований, основанной на доказательствах [5]. В разделах 7 и 8 («Лечение» и «Наблюдение») использовали систему, модифицированную из классификации Оксфордского центра медицинских исследований, основанной на доказательствах, 2009 г. [5].
Для каждой рекомендации в онлайн-режиме заполняется форма для определения силы, с учетом ряда основных элементов, на основании модифицированной методологии GRADE [6, 7]. Сила рекомендаций определяется с учетом следующих основных элементов:
- общее качество данных в поддержку рекомендаций; ссылки, используемые в этом тексте, градируются по степени согласно системе, модифицированной из классификации Оксфордского центра медицинских исследований, основанной на доказательствах [5];
- выраженность эффекта (индивидуальный или комбинированный эффект);
- убедительность результатов (точность, согласованность, неоднородность и другие статистические или связанные с исследованиями факторы);
- баланс между желательными и нежелательными исходами;
- влияние ценностей и предпочтений пациента на вмешательство;
- точность этих ценностей и предпочтений пациента.
Эти основные элементы стали основой, которую рабочая группа использует для определения силы каждой рекомендации. Она в свою очередь описана терминами «сильная» или «слабая» [7]. Сила каждой рекомендации определяется балансом между желательными и нежелательными последствиями альтернативных стратегий, качеством данных (включая точность критериев) и природой и вариабельностью ценностей и предпочтений пациентов. С целью консультирования таблицы опубликованы онлайн.
Дополнительную информацию по методологии можно найти в общем разделе «Методология» настоящего печатного издания или в онлайн-версии на сайте ЕАУ: http://www.uroweb.org/guideline/.
По указанному адресу также можно просмотреть список ассоциаций, которые оказали поддержку в составлении рекомендаций ЕАУ.
2.2. Рецензирование
Перед публикацией проведено рецензирование изменений, сделанных по результатам систематических обзоров. Кроме того, в 2019 г. выполнено рецензирование всех разделов рекомендаций.
2.3. Будущие цели
В обновления рекомендаций 2020 г. будут включены результаты продолжающихся и новых систематических обзоров. Они проводятся по стандартной методологии Кохрана для систематических обзоров; http://www.cochranelibrary.com/about/about-cochrane-systematic-reviews.html:.
В настоящее время проводятся следующие систематические обзоры:
• прогностическое исследование классификации ВОЗ 1973 и 2004 гг. и шкалы риска
EORTC 2006 г. по индивидуальным данным пациентов при первичном РМП стадии Ta-T1;
3. Эпидемиология, этиология и патогенез
3.1. Эпидемиология
РМП занимает 7-е место по распространенности у мужчин и 11-е – у лиц обоих полов [8]. По всему миру стандартизированная по возрасту частота заболевания составляет 9,0 случая на 100 000 для мужчин и 2,2 случая на 100 000 для женщин [8]. В Европейском союзе (ЕС) стандартизированные по возрасту показатели встречаемости составляют 19,1 случая на 100 000 для мужчин и 4,0 случая на 100 000 для женщин [8]. В Европе самые высокие показатели стандартизированной по возрасту встречаемости наблюдаются в Бельгии (31 у мужчин, 6,2 у женщин), а самые низкие – в Финляндии (18,1 для мужчин, 4,3 для женщин) [8].
В 2012 г. стандартизированная по возрасту смертность во всем мире от РМП на 100 000 человек составила 3,2 случая у мужчин и 0,9 у женщин [8]. Показатели встречаемости и смертности широко варьируют между странами вследствие различий в факторах риска, особенностей выявления и диагностики и доступности лечения. При этом вариации отчасти связаны с различной методологией и качеством сбора данных [9]. В ряде реестров отмечается снижение встречаемости и смертности от РМП, что, вероятно, отражает уменьшение воздействия причинных факторов [10].
Примерно у 75% пациентов РМП при диагностике ограничен слизистой (стадия Та, карцинома in situ) или подслизистой оболочкой (стадия Т1); у больных молодого возраста (< 40 лет) этот показатель еще выше [11]. Эти категории имеет высокую распространенность вследствие длительной выживаемости во многих случаях и более низкой канцероспецифической смертности по сравнению с ИРМП [8, 9].
3.2. Этиология
Курение табака – важнейший фактор риска РМП, на который приходится почти 50% случаев [9, 10, 12, 13] (УД: 3). Табачный дым содержит ароматические амины и полициклические ароматические углеводороды, которые выделяются из организма через почки.
Производственное воздействие ароматических аминов, полициклических ароматических углеводородов и хлорированных углеводородов на рабочем месте – второй по важности фактор риска РМП, на который приходится до 10% всех случаев. Такой тип воздействия имеет место в основном на промышленных предприятиях, выпускающих и использующих краски, красители, металл и нефтепродукты [9, 10, 14, 15]. В развитых промышленных странах этот риск снижается за счет рекомендаций по технике безопасности на рабочем месте, поэтому у рабочих, занятых в химической промышленности, РМП теперь встречается не чаще, чем среди населения в целом [9, 14, 15].
Несмотря на то что отягощенный семейный анамнез не оказывает значимого влияния [16] и к настоящему времени не выявлено специфических генетических вариаций при РМП, генетическая предрасположенность оказывает влияние на частоту возникновения РМП посредством повышения чувствительности к другим факторам риска [9, 17–21]. Данный факт может обусловливать семейные случаи РМП с повышением риска у родственников первой и второй линии (отношение риска: 1⁄4 1,69, 95% доверительный интервал (ДИ): 1⁄4, 1,47–1,95, p < 0,001) [22].
Хотя важность количества выпиваемой жидкости до конца не ясна, хлорирование питьевой воды и последующий уровень тригалогенметанов имеют потенциально канцерогенный эффект, при этом наличие примеси мышьяка в питьевой воде повышает риск [9, 23] (УД: 3). Прием мышьяка и курение имеют комбинированный эффект [24]. Связь между окрашиванием волос и риском остается неясной; предполагается, что риск повышен у пациентов с медленным ацетилированием NAT2 [9].
Особенности питания оказывают незначительное влияние. Флавоноиды и средиземноморская диета, характеризующаяся высоким потреблением овощей и ненасыщенных жирных кислот (оливкового масла) и умеренным потреблением белка, имеет протективный эффект в отношении риска РМП (отношение риска 0,85 (95% ДИ 0,77–0,93)) [25–30]. Воздействие ионизирующей радиации повышает риск РМП. Циклофосфамид и пиоглитазон имеют слабую связь с развитием РМП [9, 23, 31] (УД: 3). Влияние метаболических факторов (индекса массы тела, артериального давления, уровня глюкозы, холестерина и триглицеридов крови) до конца не изучено [32]. Кроме того, этиологическую роль может играть шистосомоз, хронический эндемический цистит, связанный с повторным инфицированием паразитом из класса трематод [9] (УД: 3).
3.3. Гистологические типы
В настоящих рекомендациях представлена информация только по переходно-клеточному раку, если нет других указаний.
3.4. Резюме по данным литературы по эпидемиологии, этиологии и патогенезу
| Резюме по данным литературы | УД |
|---|---|
|
Во всем мире РМП занимает 11-е место среди наиболее часто диагностированных злокачественных опухолей. |
2a |
|
Описан ряд факторов, связанных с риском развития РМП. |
3 |
4. Стадирование и классификация
4.1. Определение неинвазивного рака мочевого пузыря
Папиллярная опухоль, ограниченная слизистой и подслизистой оболочкой, относится к стадииТа и T1 соответственно по классификации TNM [33]. Плоские, ограниченные слизистой оболочкой опухоли высокой степени злокачественности классифицируют как карциному in situ (Tis). При этих опухолях можно проводить трансуретральную резекцию (ТУР) и/или внутрипузырные инстилляции, и поэтому они объединены под общим названием НИРМП с точки зрения лечения. Термин «неинвазивный рак мочевого пузыря» описывает целую группу опухолей, и во всех случаях необходимо указывать стадию T, степень дифференцировки и другие характеристики опухоли (см. разделы 4.5, 4.7 и сайт International Collaboration on Cancer Reporting website: http://www.iccr-cancer.org/datasets/ published-datasets/urinary-male-genital/carcinoma-of-the-bladder-cystectomy-cystoprostatec). Термин «поверхностный рак мочевого пузыря» больше не употребляется, поскольку он некорректен.
4.2. Классификация TNM
Принятая в 2009 г. Международным противораковым союзом (UICC) классификация TNM была пересмотрена в 2017 г. (8-е издание), однако изменения не коснулись опухолей мочевого пузыря (табл. 4.1) [33].
Таблица 4.1. Классификация рака мочевого пузыря, TNM, 2017
T - первичная опухоль
ТХ - первичная опухоль не может быть оценена
Т0 - нет данных о первичной опухоли
Ta - неинвазивная папиллярная карцинома
Tis - карцинома in situ: «плоская опухоль»
T1 - опухоль распространяется на субэпителиальную соединительную ткань
T2 - опухоль распространяется в мышечный слой
T2a - опухолевая инвазия в поверхностную мышечную ткань (внутренняя половина)
T2b - опухолевая инвазия глубокого мышечного слоя (наружная половина)
T3 - опухоль распространяется в околопузырную жировую клетчатку
T3a - микроскопическая инвазия
T3b - макроскопическая инвазия (образование за пределами мочевого пузыря)
T4 - опухолевая инвазия в одну из следующих структур: предстательная железа, матка, влагалище, стенка таза, брюшная стенка
T4a - опухолевая инвазия в предстательную железу, матку или влагалище
T4b - опухолевая инвазия в стенку таза или брюшную стенку
N - лимфатические узлы
NX - регионарные лимфатические узлы не могут быть оценены
N0 - нет метастазов в регионарных лимфатических узлах
N1 - метастазы в единичном лимфоузле в малом тазу (гипогастральном, запирательном, наружном подвздошном или предкрестцовом)
N2 - метастазы в нескольких лимфатических узлах в малом тазу (гипогастральных, запирательных, наружных подвздошных или предкрестцовых)
N3 - метастазы в общем подвздошном лимфатическом узле (узлах)
М - отдаленные метастазы
МХ - отдаленные метастазы не могут быть оценены
М0 - нет отдаленных метастазов
М1а - имеются метастазы в нерегионарных лимфоузлах
М1Ь - имеются метастазы в других локализациях
4.3. Подразделение стадии T1
По данным ретроспективных когортных исследований, глубина и степень инвазии в собственную пластинку слизистой оболочки (подразделение стадии T1) имеют прогностическое значение [34,
35] (УД: 3). Такое разделение приводится в самой последней классификации Всемирной организации здравоохранения (ВОЗ) 2016 г. [36]. К настоящему времени не определена оптимальная система
разделения стадии T1 [36, 37].
4.4. Гистологическая градация неинвазивного переходно-клеточного рака мочевого пузыря
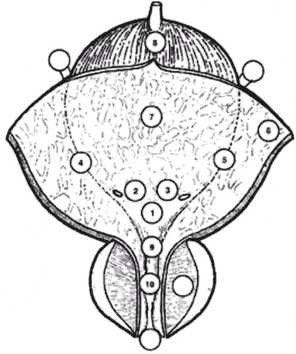
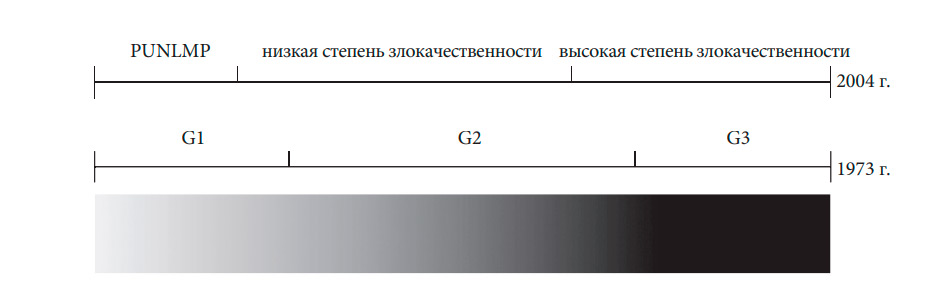
В 2004 г. ВОЗ и Международное общество урологической патологии (ISUP) опубликовали новую классификацию неинвазивных переходно-клеточных опухолей, которая дает другую стратификацию пациентов по отдельным группам по сравнению с более старой классификацией ВОЗ 1973 г. [36, 38] (табл. 4.2, 4.3, рис. 4.1). В 2016 г. было опубликовано обновление системы градации ВОЗ 2004 г., в котором не было значимых изменений [36]. Настоящие рекомендации по-прежнему основаны на классификациях 1973 и 2004/2016 гг., поскольку в большинстве публикаций используется классификация 1973 г. [39].
Таблица 4.2. Классификация степени злокачественности РМП по ВОЗ 1973 и 2004/2016 гг. [36]
Градация по ВОЗ 1973 г.
Переходно-клеточная папиллома
1-я степень: высокодифференцированная
2-я степень: умеренно дифференцированная
3-я степень: низкодифференцированная
Градация по ВОЗ 2004/2016 гг. (папиллярные образования)
Папиллярная переходно-клеточная опухоль низкого злокачественного потенциала (PUNLMP)
Переходно-клеточная карцинома низкой степени злокачественности
Переходно-клеточная карцинома высокой степени злокачественности
В систематическом обзоре и метаанализе не показано, что классификация 2004/2016 гг. превосходит классификацию 1973 г. в прогнозировании рецидива и прогрессирования [39]
(УД: 2a).
Следует отметить значительный сдвиг пациентов между прогностическими категориями в двух системах, например, увеличение числа пациентов с РМП высокой степени злокачественности (ВОЗ 2004/2016) вследствие включения части больных с РМП категории G2, несмотря на более благоприятный прогноз, чем у категории G3 (ВОЗ 1973) [39].
Согласно результатам многоцентрового анализа индивидуальных данных пациентов, за последние 10 лет пропорция опухолей, классифицируемых как PUNLMP, уменьшилась до очень низкого уровня [40]. Поскольку классификация ВОЗ 2004 г. к настоящему времени не полностью включена в прогностические модели, необходимо сравнить индивидуальные данные пациентов по обеим системам классификации при длительном
наблюдении.
Гистологический спектр переходно-клеточного рака
Рис. 4.1. Стратификация опухолей в соответствии со степенью злокачественности по классификациям ВОЗ 1973 и 2004 гг. [41]*
* Опухоли G1 по классификации ВОЗ 1973 г. разделили на папиллярные переходно-клеточные образования низкого
злокачественного потенциала (PUNLMP) и рак низкой степени злокачественности в классификации ВОЗ 2004
и 2016 гг., а опухоли G2 – на опухоли низкой и высокой степени злокачественности. Все опухоли G3 по классификации
1973 г. классифицируются как опухоли высокой степени злокачественности (воспроизведено с разрешения Elsevier).
4.5. Карцинома in situ и ее классификация
Карцинома in situ представляет собой плоскую неинвазивную переходно-клеточную карциному высокой степени злокачественности. Ее можно пропустить во время цистоскопии или принять за
воспалительные изменения, если не выполнить биопсию. Она часто имеет мультифокальный характер и может развиваться не только в мочевом пузыре, но также в верхних мочевыводящих путях,
протоках предстательной железы и простатическом отделе уретры [42].
Классификация карциномы in situ по клиническому типу [43]:
- первичная: изолированная карцинома in situ при отсутствии ранее или одновременно выявленной папиллярной опухоли или ранее выявленной карциномы in situ;
- вторичная: карцинома in situ, выявленная во время контрольной цистоскопии у пациентов, у которых ранее были другие опухоли, но не карцинома in situ;
- сопутствующая: карцинома in situ при наличии любой другой переходно-клеточной опухоли в мочевом пузыре.
Таблица 4.3. Гистологическая классификация плоских образований ВОЗ 2004 г
- Пролиферация переходно-клеточного эпителия неясного злокачественного потенциала (плоский очаг изменений без атипии или папиллярных аспектов)
- Реактивная атипия (плоский очаг изменений с атипией)
- Атипия неясного значения
- Дисплазия переходно-клеточного эпителия
- Переходно-клеточная карцинома in situ всегда имеет высокую степень злокачественности
4.6. Вариабельность определения стадии и степени злокачественности между одним и разными исследователями
Наблюдаются значительные вариации среди морфологов в диагностике карциномы in situ, которая достигает согласия только в 70–78% случаев [41] (УД: 2a). Кроме того, существует вариабельность между исследователями в классификации опухолей стадии Та и отличии их от стадии Т1, а также в определении степени злокачественности по классификации 1997 и 2004 гг. В целом согласие по определению стадии и степени злокачественности составляет от 50 до 60% [45–48] (УД: 2a). В опубликованных сравнительных работах не подтверждено, что классификация ВОЗ 2004 г. имеет более высокую воспроизводимость, чем классификация 1973 г. [39].
4.7. Другие перспективные морфологические параметры
В настоящее время используется следующая классификация [49, 50]:
- Переходно-клеточный рак (более 90% случаев).
- Переходно-клеточные раки с частичной плоскоклеточной и/или железистой или трофобластной дифференцировкой.
- Микропапиллярный переходно-клеточный рак.
- Гнездный вариант (включая крупно-гнездный вариант) и микрокистозный переходно-клеточный рак.
- Плазмоцитоидный, гигантоклеточный, перстневидный, диффузный, недифференцированный рак.
- Лимфоэпителиома-подобный рак.
- Некоторые переходно-клеточные раки с другими редкими вариантами дифференцировки.
- Мелкоклеточные раки.
- Саркоматоидный переходно-клеточный рак.
Описаны также другие варианты, встречающиеся крайне редко.
Некоторые варианты переходно-клеточного рака (например, микропапиллярный, плазмоцитоидный, гнездовой, саркоматоидный) имеют менее благоприятный прогноз, чем классические папиллярные опухоли высокой степени злокачественности [2, 51–58] (УД: 3).
Наличие лимфососудистой инвазии (ЛВИ) в препарате после ТУР связано с повышенным риском последующего повышения стадии и неблагоприятным прогнозом [59–63] (УД: 3).
4.8. Молекулярная классификация
В настоящее время изучается прогностическая роль молекулярных маркеров [64–68]. Несмотря на то что они выглядят перспективными, в особенности сложные подходы, например стратификация
пациентов на основании молекулярной классификации, их не следует применять в рутинной клинической практике [69, 70].
4.9. Резюме по данным литературы и рекомендации по классификации рака мочевого пузыря
| Резюме по данным литературы | УД |
|---|---|
|
Глубина инвазии опухоли классифицируется в соответствии с системой TNM |
2a |
|
Папиллярная опухоль, ограниченная слизистой и подслизистой оболочкой, относится к стадии Та и T1 соответственно. Плоские, ограниченные слизистой оболочкой опухоли высокой степени злокачественности классифицируют как карциному in situ (Tis) |
2a |
|
Для гистологической классификации НИРМП следует использовать классификации ВОЗ 1973 и 2004 гг. |
2a |
| Рекомендация | СР |
|---|---|
|
Глубина инвазии опухоли классифицируется в соответствии с системой TNM 2017 г. |
Сильная |
|
Для гистологической классификации следует использовать классификации ВОЗ 1973 и 2004/2016 гг. |
Сильная |
|
Не используйте термин «поверхностный рак мочевого пузыря» |
Сильная |
|
При использовании термина «неинвазивный рак мочевого пузыря» в каждом конкретном случае следует указывать стадию и степень злокачественности |
Сильная |
5. Диагностика
5.1. Анамнез пациента
Тщательный сбор анамнеза является обязательным.
5.2. Признаки и симптомы
Наиболее частым симптомом при НИРМП является гематурия. По сравнению с микрогематурией макрогематурия в качестве первого симптома связана с более высокой степенью злокачественности [68]. Карциному in situ можно заподозрить у пациентов с симптомами нарушенного мочеиспускания, особенно накопительного характера.
5.3. Физикальное исследование
Обязательно проводится тщательное физикальное обследование, хотя оно не позволяет выявить НИРМП.
5.4. Методы визуализации
5.4.1. Компьютерная томография и экскреторная урография
Компьютерная томография (КТ) позволяет определить папиллярные опухоли мочевыводящих путей, которые могут выглядеть как дефекты наполнения или вызывать гидронефроз [72]. Экскреторная урография является альтернативным вариантом, если КТ недоступна [73] (УД: 2b), но, в частности, при ИРМП и раке верхних мочевыводящих путей КТ-урография более информативна, чем экскреторная урография (включая состояние лимфоузлов и прилегающих органов).
Необходимость выполнения КТ-урографии или экскреторной урографии во всех случаях обнаружения опухоли мочевого пузыря остается под вопросом из-за низкой частоты клинически значимых изменений [74–76] (УД: 2b). Частота опухолей верхних мочевыводящих путей невелика (1,8%), но она возрастает до 7,5% при РМП, располагающемся в зоне треугольника Льето [75] (УД: 2b). Риск обнаружения опухоли верхних мочевыводящих путей во время наблюдения возрастает при многочисленных опухолях и опухолях высокого риска [77] (УД: 2b).
5.4.2. Ультразвуковое исследование
Трансабдоминальное УЗИ проводится в дополнение к физикальному исследованию, поскольку метод имеет относительно высокую чувствительность в диагностике различных патологий верхних и нижних мочевыводящих путей. УЗИ позволяет охарактеризовать образования почек, выявить гидронефроз и внутрипросветные образования в мочевом пузыре, но не позволяет исключить все возможные причины гематурии [78, 79] (УД: 3). Кроме того, УЗИ не дает возможности исключить наличие опухолей в верхних мочевыводящих путях, поэтому оно может заменить КТ-урографию.
5.4.3. Мультипараметрическая магнитно-резонансная томография
Роль мультипараметрической магнитно-резонансной томографии (мпМРТ) в диагностике и стадировании РМП до конца не определена. Недавно опубликован стандартизированный протокол описания результатов МРТ у пациентов с РМП, однако необходимо провести его валидацию [80]. Методы визуализации (экскреторная урография, КТ-урография, УЗИ или МРТ) не позволяют выявить карциному in situ (УД: 4).
5.5. Цитологическое исследование мочи
Исследование собранной при мочеиспускании мочи или смывов из мочевого пузыря на предмет наличия слущенных опухолевых клеток имеет высокую чувствительность при опухолях G3/высокой степени злокачественности (84%), но низкую чувствительность при РМП G1/низкой степени злокачественности (16%) [81]. Чувствительность цитологического исследования в диагностике карциномы in situ составляет 28–100% [82] (УД: 1b). Цитологическое исследование представляет собой полезный метод, в частности, в качестве дополнения к цистоскопии при наличии РМП G3/высокой степени злокачественности или карциномы in situ. Положительный результат цитологического исследования мочи, полученной при мочеиспускании, указывает на переходно-клеточную опухоль в любом месте мочевыводящих путей; однако отрицательный результат анализа не позволяет исключать наличие опухоли в мочевыводящих путях.
Интерпретация цитологического исследования зависит от врача-лаборанта [83, 84]. На результат могут отрицательно повлиять небольшое количество клеток, инфекция мочевыводящих путей, наличие камней или внутрипузырные инстилляции, но у опытного специалиста специфичность метода превышает 90% [83] (УД: 2b).
В 2016 г. Парижская рабочая группа опубликовала стандартизированную систему описания результатов цитологического исследования мочи [85]:
- адекватность образца мочи (адекватность);
- отсутствие переходно-клеточного рака высокой степени злокачественности (отрицательный);
- атипический переходно-клеточный эпителий (AUC);
- подозрение на переходно-клеточный рак высокой степени злокачественности (подозрение);
- переходно-клеточный рак высокой степени злокачественности (HGUC);
- переходно-клеточный рак низкой степени злокачественности (LGUN).
Парижская система валидирована в ряде ретроспективных исследований [86, 87]. Сбор мочи проводится согласно рекомендациям, представленным в разделе 5.9. Как правило, достаточно одного центрифуга Cytospin из образца мочи [88]. При подозрительном результате цитологического исследования рекомендуется его повторить [89] (УД: 2b).
5.6. Исследование молекулярных маркеров в моче
Учитывая низкую чувствительность цитологического исследования мочи, разработаны многочисленные маркеры в моче [90]. Ни один из этих маркеров не принят в качестве стандартных анализов при диагностике или наблюдении в клинической практике или рекомендациях.
В отношении доступных в настоящее время анализов можно сделать следующие выводы:
- чувствительность обычно выше за счет более низкой специфичности, сравнимой с цитологическим исследованием мочи [91–96] (УД: 3);
- доброкачественные изменения и БЦЖ-терапия влияют на уровень многих маркеров в моче [91–93] (УД: 1b);
- чувствительность и специфичность анализа на маркеры в моче зависят от клинического контекста (скрининг, первичная диагностика, наблюдение (при высоком риске, низком / промежуточном риске)) [92, 93] (УД: 3);
- выбор пациентов объясняет широкий разброс информативности маркеров, а низкая воспроизводимость может быть связана с отбором пациентов и сложностью используемых
лабораторных методов [93, 94, 97–104]; - положительный результат цитологического исследования, тестов UroVysion (FISH), NMP-22, Ucyt+, FGFR3/TERT и анализа микросателлитов у пациентов с отрицательным результатом цистоскопии и отсутствием изменений в верхних мочевыводящих путях
связан с риском раннего рецидива и, возможно, прогрессирования [98, 100, 103–107] (УД: 2b); - если основной целью является не поиск маркеров с высокой чувствительностью и специфичностью, а отказ от выполнения ненужной цистоскопии, необходимо найти маркер
с очень высокой отрицательной прогностической ценностью. Тест, который позволит прогнозировать отсутствие опухоли, окажет большое влияние на рутинную клиническую практику [108]; - в настоящее время в проспективных исследованиях оценивают новые тесты, которые основаны на различных молекулярных маркерах и имеют очень хорошую отрицательную прогностическую ценность [97, 99, 109–112].
5.7. Практическое применение цитологического исследования мочи и маркеров
Необходимо учитывать цели цитологического исследования или молекулярных анализов мочи, перечисленные ниже.
5.7.1. Массовое обследование популяции, имеющей риск развития РМП
При скрининге на РМП в группах высокого риска для выявления гематурии можно применять анализ тест-полоской, а в случае положительного результата проводить исследование на FGFR3, NMP22 или UroVision [113, 114]. Низкая частота РМП в популяции и относительно длительное выполнение анализов ухудшают их применимость и экономическую эффективность [106, 114]. Регулярное применение для скрининга не рекомендуется [106, 113, 114].
5.7.2. Обследование пациентов с гематурией или другими симптомами, позволяющими заподозрить наличие РМП (первичное выявление)
В целом принято считать, что ни один из анализов не заменит цистоскопию. Однако цитологическое исследование мочи или анализ маркеров можно использовать в дополнение к цистоскопии для выявления невидимых опухолей, в особенности карциномы in situ. В этом случае особенно важны чувствительность и специфичность в диагностике опухолей высокой степени злокачественности.
5.7.3. Наблюдение неинвазивного рака мочевого пузыря
Проводились исследования, в которых сравнивали роль цитологического исследования мочи и анализа на маркеры во время наблюдения пациентов с НИРМП [97, 98, 110, 111, 115].
5.7.3.1. Наблюдение пациентов с неинвазивным раком мочевого пузыря высокого риска
Опухоли высокого риска следует выявлять на ранних этапах, а процент пропущенных опухолей должен быть как можно ниже. Следовательно, наилучшая стратегия наблюдения в таких случаях
включает частое проведение цистоскопии и цитологического исследования.
5.7.3.2. Наблюдение пациентов с неинвазивным раком мочевого пузыря низкого и промежуточного риска
Чтобы уменьшить количество выполняемых цистоскопий, маркеры в моче должны позволить определять рецидив до того, как опухоли станут крупными и множественными. Ограничение цитологического исследования мочи состоит в низкой чувствительности к рецидивам опухолей низкой степени злокачественности. Ряд маркеров в моче имеют более высокую информативность, но попрежнему не позволяют выявить половину опухолей низкой степени злокачественности, которые определяются при цистоскопии [92, 98] (УД: 1b).
Согласно современным данным, никакие маркеры в моче не могут заменить цистоскопию во время наблюдения и не позволяют снизить частоту выполнения цистоскопии. В одном из проспективных рандомизированных исследований показано, что наличие положительного результата анализа (анализа микросателлитов) позволяет улучшить качество контрольной цистоскопии [116] (УД: 1b). Это подтверждает вспомогательную роль неинвазивных анализов мочи, которые выполняются перед проведением контрольной
цистоскопии [116] (см. раздел 8.1).
5.8. Цистоскопия
Диагноз папиллярного РМП в конечном итоге зависит от цистоскопического осмотра мочевого пузыря и гистологического исследования резецированного материала. Для диагностики карциномы
in situ используют сочетание цистоскопии, цитологического исследования мочи и гистологического исследования биоптатов из нескольких участков мочевого пузыря [117].
Цистоскопию вначале проводят амбулаторно. Гибкий инструмент и топическое применение лубриканта с анестетиком позволяют с большей вероятностью провести исследование по сравнению с ригидным эндоскопом, особенно у мужчин [118, 119] (УД: 1b).
Рис. 5.1. Схема мочевого пузыря
5.9. Резюме по данным литературы и рекомендации по первичной диагностике неинвазивного рака мочевого пузыря
| Резюме по данным литературы | УД |
|---|---|
|
Диагностика РМП основана на цистоскопии |
1 |
|
Цитологическое исследование мочи имеет высокую чувствительность в выявлении опухолей высокой степени злокачественности, включая карциному in situ |
2b |
| Рекомендации | СР |
|---|---|
|
Необходимо собирать анамнез пациента |
Сильная |
|
УЗИ почек и мочевого пузыря и/или КТ-урографию (или экскреторную урографию) можно использовать при первичном обследовании пациентов с гематурией |
Сильная |
|
При первичной диагностике РМП КТ-урографию следует выполнять только в отдельных случаях (например, при локализации опухоли в зоне треугольника Льето, множественных опухолях или опухолях высокой степени злокачественности) |
Сильная |
|
Цистоскопия рекомендована всем пациентам с симптомами, подозрительными на РМП, или при наблюдении. Ее нельзя заменить цитологическим исследованием или какими-либо другими неинвазивными методами |
Сильная |
|
У мужчин необходимо использовать гибкий уретроцистоскоп, если он имеется в наличии. |
Сильная |
|
При цистоскопии необходимо описывать все макроскопические характеристики опухоли (локализацию, размер, количество и внешний вид) и изменения слизистой оболочки. Рекомендуется использовать схему мочевого пузыря (рис. 5.1) |
Сильная |
|
Рекомендуется использовать цитологический анализ мочи, полученной при мочеиспускании, в дополнение к цистоскопии для прогнозирования наличия опухолей высокой степени злокачественности |
Сильная |
|
Цитологическое исследование выполняют на свежем образце мочи с соответствующей фиксацией |
Сильная |
|
Для цитологического исследования используют не менее 25 мл свежей мочи или мочи с адекватной фиксацией. Утренняя моча не подходит для исследования из-за часто выявляемого цитолиза |
Сильная |
|
Для описания результатов цитологического исследования необходимо использовать Парижскую систему |
Сильная |
5.10. Трансуретральная резекция опухолей мочевого пузыря стадии Ta, T1
5.10.1. Стратегия операции
Цель операции ТУР при опухолях стадии Та, Т1 заключается в том, чтобы поставить правильный диагноз и полностью удалить все видимые образования. Эта операция крайне важна для диагностики и лечения РМП. ТУР следует проводить пошагово, соблюдая следующую схему [120, 121] (см. раздел 5.14).
Этапы операции, необходимые для успешного выполнения ТУР, включают оценку факторов, позволяющих определить риск заболевания (количество опухолей, размер, мультифокальный рост, характер роста, подозрение на наличие карциномы in situ, рецидивная или первичная опухоль), стадии (бимануальная пальпация под анестезией, оценка клинической стадии опухоли), адекватности резекции (визуально полная резекция, наличие мышцы в дне резекции) и осложнений (например, перфорации) [120, 121]. Для измерения размера самой крупной опухоли можно использовать резекционную петлю, диаметр которой составляет около 1 см. Характер роста опухоли может быть сидячим, узловым, папиллярным или плоским.
5.10.2. Хирургические и технические аспекты резекции опухоли
5.10.2.1. Хирургическая стратегия резекции (резекция по частям, en-bloc резекция)
Хорошая резекция обеспечивает благоприятный прогноз [114]. Полную резекцию можно выполнить по частям или en-bloc [120, 123].
- Резекция по частям (отдельные срезы экзофитной части опухоли, подлежащей стенки мочевого пузыря и краев резекции) дает хорошую информацию по вертикальному и горизонтальному распространению опухоли [124] (УД: 2b).
- При отдельных экзофитных опухолях можно выполнить резекцию en-bloc монополярной или биполярной петлей, тулиевым или гольмиевым лазером. Высокое качество резекции опухолей подтверждается наличием детрузора в 96–100% случаев [120, 125–128] (УД: 1b).
Стратегия резекции зависит от размера и локализации опухоли и опыта хирурга.
5.10.2.2. Оценка качества резекции
Показано, что отсутствие детрузора в препарате связано со значительно более высоким риском резидуальной опухоли, рецидива и недооценки стадии [129] (УД: 1b). Наличие детрузора в препарате считается суррогатным критерием качества резекции и является обязательным (кроме опухолей стадии TaG1/низкой степени злокачественности).
С накоплением опыта результаты ТУР улучшаются, что свидетельствует о роли программ обучения [131]. В настоящее время развивается виртуальное обучение на симуляторах [121]. Необходимо определить его роль в системе обучения.
5.10.2.3. Монополярная и биполярная резекция
По сравнению с монополярной резекцией биполярная электрокоагуляция позволяет уменьшить риск осложнений (например, перфорации мочевого пузыря из-за стимуляции запирательного нерва) и получить более качественный препарат для морфологического исследования. Тем не менее результаты остаются противоречивыми [132–135].
5.10.2.4. Амбулаторная фульгурация и лазерная вапоризация
У пациентов с небольшими опухолями стадии Ta низкой степени злокачественности/G1 в анамнезе прижигание (фульгурация) или лазерная вапоризация небольших папиллярных рецидивных образований в амбулаторных условиях позволяет уменьшить травматичность лечения [136, 137] (УД: 3).
К настоящему времени не проводилось проспективных сравнительных исследований, в которых бы оценивали онкологические результаты.
5.10.2.5. Резекция небольших папиллярных опухолей мочевого пузыря во время трансуретральной резекции предстательной железы
В литературе представлены ограниченные ретроспективные данные по результатам резекции папиллярных образований мочевого пузыря, выявленных во время цистоскопии перед ТУР предстательной железы. При условии папиллярного характера этих опухолей, относительно небольшого размера и небольшого числа после их резекции можно продолжить ТУР предстательной железы. При этом отсутствует точная оценка риска [138, 139].
5.10.3. Биопсия мочевого пузыря
Карцинома in situ может представлять собой бархатистый участок красноватого цвета, неотличимый от воспаления. Кроме того, она может быть невидимой. По этой причине рекомендуется брать
биопсию из всех участков измененного переходно-клеточного эпителия. При положительном результате цитологического исследования или наличии в анамнезе РМП G3/высокой степени злокачественности, а также при опухолях непапиллярного характера показана мультифокальная биопсия слизистой, имеющей нормальный вид, с картированием [140, 141]. Для получения репрезентативной картины необходимо взять биопсию слизистой из треугольника, основания, правой, левой боковой стенки, передней и задней стенки мочевого пузыря [140, 141]. При доступности оборудования фотодинамическая диагностика (ФДД) повышает чувствительность рандомной биопсии.
5.10.4. Биопсия простатического отдела уретры
У мужчин с НИРМП описано поражение простатического отдела уретры и протоков предстательной железы. Palou и соавт. [142] показали, что у 128 мужчин с РМП стадии Т1G3 частота карциномы in situ в простатическом отделе уретры составляла 11,7% (УД: 2b). Риск поражения простатического отдела уретры и протоков предстательной железы выше, если опухоль расположена в треугольнике Льето или шейке мочевого пузыря, при наличии карциномы in situ мочевого пузыря и множественных опухолей [143] (УД: 3).
На основании этих данных в ряде случаев рекомендуется выполнить биопсию простатической уретры (см. рекомендации в разделе 5.14) [142, 144, 145].
5.11. Новые методы визуализации опухоли
Стандартная цистоскопия и ТУР проводятся при обычном («белом») освещении. Однако использование такого освещения приводит к тому, что некоторые образования остаются невидимыми, в связи с чем были разработаны новые методы.
5.11.1. Фотодинамическая диагностика (флуоресцентная цистоскопия)
ФДД выполняется с использованием фиолетового освещения после введения в мочевой пузырь 5-аминолевулиновой кислоты (ALA) или гексаминолевулиновой кислоты (HAL). Показано, что биопсия и резекция с использованием флуоресцентного метода более чувствительны, чем стандартные операции, в выявлении злокачественных опухолей, в частности карциномы in situ [146, 147] (УД: 1a). Согласно результатам систематических обзоров и метаанализов, ФДД превышает по чувствительности эндоскопию при обычном освещении в объединенной оценке анализов как на уровне пациента (92 и 71%), так и на уровне биопсии (93 и 65%) [147]. В проспективном рандомизированном исследовании не подтверждено, что положительный результат цитологического исследования перед ТУР повышает частоту выявления РМП [148].
ФДД имеет более низкую специфичность, чем эндоскопия при обычном освещении (63 и 81%) [147]. Ложноположительные результаты возможны в случае воспаления, недавно выполненной ТУР и в первые три месяца после проведения БЦЖ-терапии [149, 150] (УД: 1a).
В проспективных рандомизированных исследованиях оценивали влияние ТУР с использованием ALA-флуоресценции на частоту рецидива РМП. В систематическом обзоре и метаанализе, включавшем 14 рандомизированных исследований (n = 2906), сравнивали ФДД с ALA (6 исследований) и HAL (9 исследований). Результаты свидетельствуют о снижении частоты рецидива при ближайшем и отдаленном наблюдении. При этом не выявлено различий в показателях прогрессирования и смертности. В анализе отмечены различия между исследованиями и риск искажений по технике операции и публикации результатов [151] (УД: 1a).
В рандомизированном исследовании показано снижение риска рецидива и прогрессирования после ТУР-биопсии под контролем ФДД по сравнению со стандартной ТУР-биопсией [152].
Данные результаты необходимо валидировать в последующих исследованиях.
5.11.2. Узкополосная визуализация
В методе узкополосной визуализации (NBI) повышается контраст между нормальным переходно-клеточным эпителием и опухолевой тканью с усиленным кровотоком. В когортных исследованиях, а также небольшом одноцентровом проспективном рандомизированном исследовании показано улучшение выявления рака при осмотре мочевого пузыря гибким цистоскопом в режиме NBI, биопсии и резекции под контролем NBI [153–156] (УД: 3b). В рандомизированном исследовании оценивали снижение риска рецидива РМП при использовании NBI во время ТУР. Несмотря на то что в целом в исследовании получены отрицательные результаты, при опухолях низкого риска (pTa низкой степени злокачественности, < 30 мм, отсутствие карциномы in situ) отмечалось снижение частоты рецидива [157] (УД: 1b).
5.11.3. Дополнительные технологии
Конфокальная лазерная микроэндоскопия основана на использовании визуализирующего датчика с высоким разрешением, разработанного для определения степени злокачественности во время эндоскопического исследования в режиме реального времени. Метод требует дальнейшей валидации [158]. Система профессионального усиления изображения Storz (IMAGE1 S, прежнее название SPIES) включает четыре различные линии спектра. К настоящему времени не получено проспективных данных [159].
5.12. Повторная резекция
5.12.1. Выявление резидуальных образований и повышение стадии опухоли
В литературе показан значительный риск резидуальной опухоли после ТУР РМП стадии Та, Т1 [123] (УД: 1b). По данным недавно опубликованного систематического обзора, в котором проанализировали 8409 пациентов с РМП стадии Ta/высокой степени злокачественности и T1, риск сохранения опухоли при стадии T1 составляет 51%, а недооценки стадии – 8%. В анализе также показан высокий риск резидуальной опухоли при РМП стадии Ta, но результаты основаны на небольшом количестве пациентов.
В большинстве случаев резидуальная опухоль выявляется в зоне первичной резекции [148] (УД: 1a).
По данным другого метаанализа (n = 3556), при стадии T1 частота выявления резидуальной опухоли и повышения стадии до ИРМП остается высокой даже в подгруппе пациентов с наличием детрузора в препарате. В подгруппе из 1565 больных РМП стадии T1 и наличием детрузора в препарате резидуальная опухоль выявлена в 58%, а в 11% случаев была повышена стадия [161].
5.12.2. Влияние повторной резекции на результаты лечения
Показано, что повторная ТУР повышает безрецидивную выживаемость (БРВ) [162, 163] (УД: 2a), улучшает результаты БЦЖ-терапии [164] (УД: 3) и дает важную прогностическую информацию [165–168] (УД: 3).
По данным ретроспективного анализа крупной когорты из 2451 пациента с РМП стадии T1G3/высокой степени злокачественности после БЦЖ-терапии, которым проводилось лечение в нескольких клиниках, выполнение повторной резекции (n = 935) улучшает БРВ, выживаемость без прогрессирования (ВБП) и общую выживаемость (ОВ) только при отсутствии детрузора в препарате после первой резекции [169] (УД: 3).
5.12.3. Время выполнения повторной резекции
В ретроспективном анализе показано, что повторная резекция через 14–42 дня повышает БРВ и ВБП по сравнению с ее выполнением через 43–90 дней [170] (УД: 3). На основании этих данных в отдельных случаях через 2–6 недель после первичной резекции рекомендуется повторная ТУР (в разделе 5.14 представлены рекомендации по отбору пациентов).
5.12.4. Запись результатов
Результаты повторной резекции (наличие резидуальной опухоли и повышение стадии) свидетельствуют о качестве первичной ТУР. С целью улучшения качества ТУР необходимо анализировать
результаты повторной резекции.
5.13. Морфологическое заключение
Морфологическое исследование препарата после ТУР и биопсии является важным этапом диагностики и определения тактики лечения РМП [171]. Рекомендуется тесное сотрудничество между урологом и морфологом. Для правильной патоморфологической оценки крайне важно высокое качество резецированной и отправленной на исследование ткани. Для правильной оценки категории Т требуется достаточное количество мышечной ткани. Чтобы получить всю необходимую информацию, при заборе ткани, обработке и исследовании необходимо соблюдать представленные ниже рекомендации (см. раздел 5.14) [172, 173]. В сложных случаях необходимо отправить препарат на пересмотр морфологу, специализирующемуся на патологии органов мочеполовой системы.
5.14. Резюме по данным литературы и рекомендации по ТУР мочевого пузыря и протоколу патоморфологического исследования
| Резюме по данным литературы | уд |
|---|---|
|
ТУР мочевого пузыря с последующим морфологическим исследованием препарата является важным этапом лечения НИРМП |
1 |
|
Отсутствие детрузора в препарате связано со статистически значимо более высоким риском резидуальной опухоли и недооценки стадии |
2b |
|
У пациентов с небольшими опухолями стадии Ta низкой степени злокачественности/(1 прижигание (фульгурация) небольших папиллярных рецидивных образований в амбулаторных условиях является эффективным и безопасным методом |
3 |
|
Повторная ТУР позволяет выявить резидуальные опухоли и недооценку стадии, повысить безрецидивную выживаемость, улучшить результаты БЦЖ-терапии и дает важную прогностическую информацию |
2 |
| Рекомендации | СР |
|---|---|
|
При подозрении на РМП рекомендуется выполнить ТУР с последующим морфологическим исследованием препарата в качестве метода диагностики и первого шага в лечении |
Сильная |
|
Пациентам с рецидивом небольших образований при наличии в анамнезе опухолей стадии Ta низкой степени злокачественности/Gl можно выполнять прижигание (фульгурацию) или лазерную вапоризацию в амбулаторных условиях |
Слабая |
|
ТУР следует проводить пошагово, соблюдая следующую схему:
|
Сильная |
|
Необходимо выполнить отдельные шаги: |
|
|
Резекция единым блоком или поэтапно, включения экзофитную часть опухоли, подлежащую стенку мочевого пузыря с детрузором и края зоны резекции. Кроме опухолей стадии TaG1, обязательно наличие детрузора в препарате |
Сильная |
|
Следует максимально избегать электрокоагуляции во время ТУР, чтобы не повредить препарат |
Сильная |
|
Необходимо взять биопсию из любого измененного участка. Биопсия внешне нормальной слизистой (треугольник Льето, дно мочевого пузыря, правая, левая, передняя и задняя стенки мочевого пузыря) рекомендуется только в случае положительного результата цитологического исследования мочи, опухоли высокой степени злокачественности/Ѳ3 в анамнезе или если экзофитная опухоль не выглядит как папиллярная. Если доступно оборудование, следует выполнить биопсию под контролем ФДД |
Сильная |
|
Биопсия простатического отдела уретры рекомендуется в тех случаях, когда опухоль расположена в шейке пузыря, имеется или подозревается карцинома in situ, положительный результат цитологического исследования без наличия опухоли в мочевом пузыре или при видимых изменениях в простатическом отделе уретры. Если биопсия не сделана в ходе первичной ТУР, ее необходимо выполнить при повторной резекции |
Сильная |
|
Биопсию простатической уретры берут из зоны изменений и преколликулярной области (между 5 и 7 часами условного циферблата) с помощью резекционной петли. При первичных неинвазивных опухолях, когда нет оснований подозревать прорастание в строму, можно выполнить «холодную» биопсию с помощью щипцов |
Слабая |
|
Для улучшения визуализации опухоли следует использовать дополнительные методы (ФДД, NBI), если они доступны |
Слабая |
|
Биоптаты из различных зон и резецированные фрагменты необходимо направлять морфологу в отдельных контейнерах и с отдельными надписями |
Слабая |
|
В протоколе ТУР следует описать локализацию, внешний вид и размер опухоли, все этапы операции, а также степень и полноту резекции |
Сильная |
|
При положительном результате цитологического исследования и отсутствии изменений при цистоскопии необходимо исключить переходно-клеточный рак верхних мочевыводящих путей, карциному in situ мочевого пузыря (мультифокальная биопсия или биопсия под контролем ФДД) и поражение простатического отдела уретры (биопсия) |
Сильная |
|
Показания для повторной ТУР включают следующее: |
|
|
Сильная |
|
При наличии показаний повторную ТУР выполняют через 2-6 недель после первой резекции. Она должна включать резекцию зоны локализации первичной опухоли |
Слабая |
|
Необходимо анализировать результаты повторной ТУР, поскольку они отражают качество первичной резекции |
Слабая |
|
Рекомендуется информировать морфолога о предыдущем лечении (внутрипузырная, лучевая терапия и т.д.) |
Сильная |
|
В протоколе гистологического исследования следует указать локализацию опухоли, ее степень злокачественности и стадию, наличие лимфососудистой инвазии или необычного гистологического варианта, наличие карциномы in situ и то, присутствует ли в препарате участок детрузора |
Сильная |
6. Прогнозирование рецидива и прогрессирования рака мочевого пузыря
6.1. Опухоли стадии Ta, T1
Тактика лечения зависит от прогноза пациента. Для индивидуального прогнозирования ближайшего и отдаленного риска рецидива и прогрессирования РМП группа по лечению рака мочеполовой системы Европейской организации по изучению и лечению рака (EORTC) разработала шкалы и таблицы рисков [161]. Они основаны на базе данных, включающей 2596 пациентов с РМП стадии Та и Т1, которые были рандомизированы в 7 исследованиях EORTC. Больных, у которых выявлена только карцинома in situ, в эту базу не включали. Внутрипузырная терапия, в основном химиотерапия, проводилась 78% пациентов. При этом им не выполнялась повторная ТУР или поддерживающий курс БЦЖ-терапии.
Балльная шкала оценки основана на шести наиболее важных клинических и патологических факторах, которые представлены в табл. 6.1. В ней также описана шкала, применяемая к различным факторам при расчете общего балла для оценки рецидива и прогрессирования. В таблице
6.2 показаны стратифицированные общие показатели по четырем категориям, которые отражают различные вероятности рецидива и прогрессирования через год и 5 лет [174] (УД: 2a).
| Балл по рецидиву | Вероятность рецидивирования в течение года | Вероятность рецидивирования в течение 5 лет | ||
|---|---|---|---|---|
|
% |
(95% ДИ) |
% |
(95% ДИ) |
|
|
0 |
15 |
(10-19) |
31 |
(24-37) |
|
1-4 |
24 |
(21-26) |
46 |
(42-49) |
|
5-9 |
38 |
(35-41) |
62 |
(58-65) |
|
10-17 |
61 |
(55-67) |
78 |
(73-84) |
| Балл по рецидиву | Вероятность рецидивирования в течение года | Вероятность рецидивирования в течение 5 лет | ||
|---|---|---|---|---|
|
% |
(95% ДИ) |
% |
(95% ДИ) |
|
|
0 |
15 |
(10-19) |
31 |
(24-37) |
|
1-4 |
24 |
(21-26) |
46 |
(42-49) |
|
5-9 |
38 |
(35-41) |
62 |
(58-65) |
|
10-17 |
61 |
(55-67) |
78 |
(73-84) |
| Балл по прогрессированию | Вероятность прогрессирования в течение года | Вероятность прогрессирования в течение 5 лет | ||
|---|---|---|---|---|
|
% |
(95% ДИ) |
% |
(95% ДИ) |
|
|
0 |
0,2 |
(0-0,7) |
0,8 |
(0-1,7) |
|
2-6 |
1 |
(0.4-1.6) |
6 |
(5-8) |
|
7-13 |
5 |
(4-7) |
17 |
(14-20) |
|
14-23 |
17 |
(10-24) |
45 |
(35-55) |
Примечание. Электронные калькуляторы для табл. 6.1 и 6.2 включены в мобильные приложения Apple
и Android по ссылке: https://www.eortc.be/tools/bladdercalculator/download_disclaimer.htm.
В недавно опубликованном исследовании авторы рассчитывали прогноз у пациентов с РМП промежуточного риска, которые получали химиотерапию. Больных РМП стадии Ta G1/G2, получивших химиотерапию, стратифицировали на три группы риска рецидива, в зависимости от наличия рецидива в анамнезе, ранее проводимой внутрипузырной химиотерапии, степени злокачественности, количества опухолей и проведения адъювантной химиотерапии [175].
Организация Club Urológico Español de Tratamiento Oncológico (CUETO) (Испанская группа по онкологической урологии) опубликовала шкалу оценки в баллах для пациентов, получавших БЦЖ-терапию,
которая позволяет прогнозировать ближайший и отдаленный риск рецидива и прогрессирования.
Она основана на анализе 1062 пациентов из четырех клинических исследований CUETO, в которых сравнивали различные варианты внутрипузырной БЦЖ-терапии. Пациенты получали 12 инстилляций в течение 5–6 месяцев, им не проводилось немедленной послеоперационной внутрипузырной химиотерапии или повторной ТУР. Шкала оценки включает семь прогностических факторов:
- пол;
- возраст;
- предыдущая частота рецидивов;
- количество опухолей;
- категория Т;
- сопутствующая карцинома in situ;
- степень злокачественности опухоли.
При использовании табл. 6.1 и 6.2 расчетный риск рецидива ниже, чем полученный по таблицам EORTC. Вероятность прогрессирования ниже только в случае РМП высокого риска [176] (УД: 2a).
Более низкий риск в таблицах CUETO может быть связан с использованием БЦЖ-терапии, которая является более эффективной формой внутрипузырной терапии.
Прогностическое значение шкалы EORTC подтверждено данными больных в исследованиях CUETO, которым проводилась БЦЖ-терапия, и отдаленными результатами наблюдения независимой группы пациентов [177, 178] (УД: 2a).
В исследовании EORTC 1812 пациентов с РМП промежуточного и высокого риска без карциномы in situ получали поддерживающий курс БЖЦ-терапии в течение 1–3 лет. Результаты показали, что предыдущая частота рецидивов и количество опухолей являются наиболее важными прогностическими факторами рецидива, стадия и степень злокачественности – прогрессирования заболевания и канцероспецифической выживаемости, а возраст и степень злокачественности – общей выживаемости. У пациентов с РМП стадии T1G3 прогноз неблагоприятный, с показателями одно- и пятилетней выживаемости без прогрессирования 11,4 и 19,8% соответственно. На основании этих данных разработаны новые таблицы риска EORTC для больных, которые получали
БЦЖ-терапию [179] (УД: 2a).
Для отдельных популяций пациентов описаны дополнительные прогностические факторы.
- При РМП стадии T1G3 женский пол и карцинома in situ в простатическом отделе уретры являются важными прогностическими факторами у пациентов, которым проводился индукционный курс БЦЖ-терапии, так же как и возраст, размер опухоли и наличие карциномы in situ у больных, получавших БЦЖ-терапию (у 62% выполнен только индукционный курс) [142, 180] (УД: 2b).
- Особое внимание следует уделять пациентам с РМП стадии T1G3 в псевдодивертикуле мочевого пузыря, поскольку в стенке дивертикула отсутствует мышечный слой [181] (УД: 3).
- При РМП высокого риска стадия опухоли при выполнении второй ТУР является неблагоприятным прогностическим фактором [166–168] (УД: 3).
- Рецидив после трех месяцев считается наиболее важным прогностическим фактором прогрессирования опухолей T1G2 после ТУР [182] (УД: 2b)
- Прогностическое значение морфологических факторов обсуждается в других разделах (см. раздел 4.6). Требуется провести больше исследований для оценки роли молекулярных маркеров в улучшении прогностической точности предложенных в настоящее время таблиц риска [177, 183].
- Предоперационное отношение нейтрофилов к лимфоцитам может иметь прогностическое значение при НИРМП, однако необходимо провести дальнейшую валидизацию [184].
6.2. Карцинома in situ
Без лечения карцинома in situ в 54% случаев прогрессирует до ИРМП [185] (УД: 3). К сожалению, отсутствуют достоверные прогностические факторы, однако в ряде исследований показано, что прогноз ухудшается при одновременном наличии карциномы in situ и опухолей стадии Т1 по сравнению с первичной карциномой in situ [186, 187], в случае обширной карциномы in situ [188] и карциномы in situ в области простатического отдела уретры [142] (УД: 3).
Ответ на внутрипузырную БЦЖ-терапию или химиотерапию является важным прогностическим фактором последующего прогрессирования и смерти от РМП [176–178, 182]. У 10–20% больных с полным ответом на терапию в последующем наблюдается прогрессирование до ИРМП, а при неэффективности внутрипузырной терапии этот показатель достигает 66% [189, 190] (УД: 2a).
6.3. Стратификация пациентов по группам риска
Рабочая группа ЕАУ рекомендует стратифицировать пациентов по трем группам риска. В таблице
6.3 представлены критерии этих групп риска с учетом вероятностей рецидивирования и в особенности прогрессирования из таблиц EORTC.
6.4. Подгруппа опухолей самого высокого риска
На основании прогностических факторов можно выделить из опухолей высокого риска группу с самым высоким риском прогрессирования. К ней относятся опухоли стадии T1G3/высокой степени злокачественности с сопутствующей карциномой in situ, множественные и/или крупные опухоли T1G3/высокой степени злокачественности и/или рецидивные опухоли T1G3/высокой степени злокачественности, T1G3/ высокой степени злокачественности + карцинома in situ в простатическом отделе уретры, некоторые редкие гистологические варианты и опухоли стадии T1 с лимфососудистой инвазией (табл. 6.3).
| Стратификация по группам риска | Характеристики |
|---|---|
|
Опухоли низкого риска |
Первичные единичные опухоли стадии Ta, (1 (PUNLMP, низкой степени злокачественности*), размером < 3 см, без карциномы in situ |
|
Опухоли промежуточного риска |
Все опухоли, не попадающие в две смежные категории (между категориями низкого и высокого риска) |
|
Опухоли высокого риска |
Любые из указанных ниже:
|
| Подгруппа опухолей самого высокого риска: | |
|
Опухоли стадии Т1(3/высокой степени злокачественности + карцинома in situ, множественные и/или крупные опухоли Т1(3/высокой степени злокачественности и/или рецидивные опухоли Т1(3/высокой степени злокачественности, Т1(3/высокой степени злокачественности + карцинома in situ в простатическом отделе уретры, опухоли необычного гистологического типа, лимфососудистая инвазия |
В таблице 7.2 представлено подразделение опухолей высокого риска для клинических интересов:
* низкая степень злокачественности включает G1 и G2;
** высокая степень злокачественности включает часть опухолей G2 и все опухоли G3 (см. рис. 4.1)
6.5. Резюме по данным литературы и рекомендации по стратификации неинвазивного рака
мочевого пузыря
| Резюме по данным литературы | УД |
|---|---|
|
Шкала EORTC и таблицы риска позволяют индивидуально прогнозировать ближайший и отдаленный риск рецидива и прогрессирования НИРМП |
2a |
|
Больных РМП стадии Ta G1/G2, получивших химиотерапию, можно стратифицировать на три группы риска рецидива в зависимости от наличия рецидива в анамнезе, ранее проводимой внутрипузырной химиотерапии, степени злокачественности, количества опухолей и проведения адъювантной химиотерапии |
2a-b |
|
Шкала CUETO позволяет прогнозировать ближайший и отдаленный риск рецидива и прогрессирования у больных, получавших БЦЖ-терапию в течение 5-6 месяцев |
2a |
|
У пациентов, которые получают поддерживающий курс БЦЖ-терапии, предыдущая частота рецидивов и количество опухолей являются наиболее важными прогностическими факторами рецидива; стадия и степень злокачественности являются наиболее важными прогностическими факторами прогрессирования заболевания и канцероспецифической выживаемости; возраст и степень злокачественности являются наиболее важными прогностическими факторами общей выживаемости |
2a |
| Рекомендации | СР |
|---|---|
|
Стратифицируйте пациентов по трем группам риска в соответствии с табл. 6.3 |
Сильная |
|
Используйте таблицы риска EORTC и калькуляторы для оценки индивидуального прогноза риска рецидива опухоли и ее прогрессирования спустя различное время после ТУР |
Сильная |
|
Для индивидуального прогнозирования рецидива и прогрессирования опухоли у пациентов, которые получают БЦЖ-терапию, следует использовать таблицы риска CUETO и новые таблицы риска EORTC |
Сильная |
7. Лечение
7.1. Рекомендации по прекращению курения
Показано, что курение повышает риск прогрессирования и рецидива опухоли [191, 192] (УД: 3). Хотя остается неясным, влияет ли отказ от курения положительно на результаты лечения РМП, всем курильщикам следует рекомендовать бросить курить, учитывая общие риски, связанные с курением табака [181, 193–195] (УД: 3).
7.2. Адъювантная терапия
7.2.1. Внутрипузырная химиотерапия
Хотя ТУР позволяет полностью удалить опухоли стадии Та, Т1, они могут рецидивировать и прогрессировать в ИРМП. Высокая вариабельность в трехмесячной частоте рецидива свидетельствует о том, что ТУР выполнена не полностью или провоцирует рецидив у значительной части пациентов [123]. По этой причине всем пациентам необходимо проводить адъювантную терапию.
7.2.1.1. Однократная немедленная послеоперационная внутрипузырная химиотерапия
Однократная немедленная внутрипузырная химиотерапия действует посредством разрушения циркулирующих опухолевых клеток после ТУР и аблативного влияния (хеморезекции) на резидуальные опухолевые клетки в зоне резекции и мелкие незамеченные опухоли [196–199] (УД: 3).
В четырех крупных метаанализах, которые включали от 1476 до 3103 больных, показано, что однократная немедленная внутрипузырная химиотерапия после ТУР значительно снижает частоту рецидивирования по сравнению с ТУР без химиотерапии [200–203] (УД: 1a). В систематическом обзоре и метаанализе индивидуальных данных 2278 пациентов [200] однократная внутрипузырная химиотерапия позволила снизить пятилетнюю частоту рецидивов на 14%, с 59 до 45%. Для профилактики одного рецидива в течение 5 лет необходимо пролечить 7 пациентов. Внутрипузырная химиотерапия эффективна только у пациентов с низкой частотой рецидива (один рецидив в год и реже) и показателем рецидива по шкале EORTC < 5. У больных с показателем по шкале EORTC 5 баллов и выше и/или частотой рецидива > 1 в год внутрипузырная терапия в виде однократного адъювантного лечения неэффективна.
К настоящему времени не проводилось рандомизированных исследований, посвященных сравнению препаратов [200–203].
В качестве внутрипузырной химиотерапии успешно применяются митомицин C (MMC), эпирубицин и пирарубицин [200]. По данным рандомизированного исследования (около 200 пациентов в каждой группе), однократная инстилляция гемцитабина по эффективности превосходит плацебо (физиологический раствор) [204], с низкими показателями токсичности [204].
Эти результаты противоречат предыдущему исследованию, в котором была ниже длительность инстилляции [205]. В исследовании Böhle и соавт. в обеих группах использовали промывную систему физиологическим раствором в течение 24 часов после операции, что может объяснять низкую частоту рецидива в контрольной группе и поднимает вопрос об эффективности промывной системы в профилактике раннего рецидива [205]. В двух метаанализах показана эффективность непрерывной ирригации мочевого пузыря физиологическим раствором для профилактики раннего рецидива [206, 207].
Профилактика имплантации опухолевых клеток должна проводиться в первые часы после ТУР. Уже через несколько часов клетки прочно имплантируются и покрываются межклеточным матриксом [196, 208–210] (УД: 3). Во всех исследованиях, в которых оценивали однократную внутрипузырную химиотерапию, ее проводили в течение 24 часов после операции. В двух рандомизированных исследованиях не выявлено эффективности однократного введения апазиквона; напротив, в дополнительном анализе показано снижение риска рецидива у пациентов, которым вводили апазиквон в течение 90 минут после ТУР [211]. Для достижения максимальной эффективности инстилляции рекомендуются гибкие методики, которые позволят начать химиотерапию как можно раньше после ТУР, желательно в течение первых двух часов, в палате пробуждения или даже непосредственно в операционной. Поскольку в случае экстравазации препарата у пациентов наблюдались тяжелые осложнения [212, 213], необходимо соблюдать меры предосторожности (см. раздел 7.5).
7.2.1.2. Дополнительная адъювантная внутрипузырная химиотерапия
Необходимость в последующей адъювантной внутрипузырной терапии зависит от прогноза. При РМП низкого риска (табл. 6.1, 6.2 и 6.3) однократная немедленная химиотерапия снижает риск рецидива и считается стандартным и полным вариантом лечения [200, 201] (УД: 1a). Для других групп риска, однако, однократная немедленная химиотерапия является недостаточным вариантом лечения из-за значительного риска рецидива и/или прогрессирования (табл. 6.1, 6.2 и 6.3).
В литературе опубликованы следующие сравнительные данные по эффективности.
Однократная инстилляция по сравнению с однократной инстилляцией и повторным введением препарата
В одном исследовании [214] показано, что последующие сеансы внутрипузырной химиотерапии после однократного введения препарата улучшают безрецидивную выживаемость при РМП промежуточного риска (УД: 2a).
Повторные инстилляции по сравнению с отсутствием адъювантной терапии
В крупном метаанализе, включавшем 3703 больных из 11 рандомизированных исследований, показана высокая статистическая значимость снижения риска рецидива на 44% в течение года в пользу химиотерапии по сравнению с ТУР без химиотерапии [215]. Это соответствует абсолютной разнице в 13–14% по количеству пациентов с рецидивами. В отличие от этих данных в двух метаанализах обнаружено, что БЦЖ-терапия уменьшает риск прогрессирования опухоли [216, 217] (УД: 1а) (см. раздел 7.2.2.1). Кроме того, поддерживающая БЦЖ-терапия значительно превосходит химиотерапию в профилактике рецидива [218–220] (см. раздел 7.2.2.1) (УД: 1a). Однако БЦЖ-терапия вызывает значительно больше побочных эффектов, чем химиотерапия [220] (УД: 1a).
Однократная инстилляция с повторным введением препарата по сравнению только с отсроченным введением препарата
По данным ряда исследований, у пациентов с РМП промежуточного риска ранняя инстилляция оказывает влияние на частоту рецидива даже при проведении повторных введений препарата [221– 224]. В рандомизированном исследовании, в которое вошло 2243 больных с НИРМП, сравнивали немедленную инстилляцию митомицина C с инстилляцией, выполненной через две недели после ТУР (с последующим проведением инстилляций в обеих группах). Согласно результатам, в группе немедленной инстилляции риск рецидива в течение трех лет снижался на 9%, с 36 до 27%. Эффект был статистически значимым в группе промежуточного и высокого риска у больных, получавших дополнительные адъювантные инстилляции митомицина C [221] (УД: 2a). К сожалению, критерии групп риска значительно отличались от рекомендуемых в настоящее время. Как следствие, ряд пациентов не получили адекватную терапию, и поэтому исследование не смогло достоверно ответить на вопрос, повышает ли проведение немедленной инстилляции после ТУР эффективность последующих инстилляций [225]. Необходимо с осторожностью интерпретировать результаты данного исследования, поскольку ряд пациентов не получили стандартного лечения (БЦЖ-терапия при РМП высокого риска). В рандомизированном исследовании, включавшем когорту пациентов с преобладанием РМП высокого риска, не показано эффективности однократного введения эпирубицина с последующей внутрипузырной химиотерапией или БЦЖ-терапией [226].
Оптимальная схема внутрипузырной терапии
Оптимальная длительность и частота сеансов химиотерапии не определены, однако ее не рекомендуется проводить более года [224] (УД: 3).
7.2.1.3. Оптимизация эффективности внутрипузырной химиотерапии
7.2.1.3.1.Изменение pH, длительности инстилляции и концентрации препарата
Изменение рН мочи, снижение диуреза и буферизация внутрипузырного раствора снижают частоту рецидивов [227] (УД: 1b). Часовой сеанс MMC превосходит по эффективности 30-минутный, но сравнения эффективности часовых и двухчасовых инстилляций не проводилось [228] (УД: 3). В другом рандомизированном исследовании с использованием эпирубицина обнаружено, что концентрация препарата важнее длительности сеанса [229] (УД: 1b). С учетом этих данных, рекомендуется предоставлять пациентам инструкции (см. раздел 7.5).
7.2.1.3.2.Внутрипузырная химиотерапия со вспомогательными методиками
Микроволновая гипертермия
Получены многообещающие данные о повышении эффективности MMC с использованием микроволновой гипертермии у пациентов с опухолями высокого риска [230]. В рандомизированном исследовании, в котором сравнивали БЦЖ-терапию и ММС с микроволновой гипертермией в течение года у пациентов с РМП промежуточного и высокого риска, показано снижение БРВ через 24 месяца в группе ММС [231] (УД: 1b).
Внутрипузырная химиотерапия с гипертермией
Описаны различные технологии для повышения температуры вводимого ММС, однако в настоящее время отсутствуют данные по их эффективности.
Электрофорез (EDMA)
В небольшом рандомизированном исследовании подтверждена эффективность ММС с использованием EDMA у больных с РМП высокого риска [215]. Тем не менее эти данные требуют подтверждения.
Применение вспомогательных методик при отсутствии ответа на БЦЖ-терапию описано в разделе 7.3.3.
7.2.1.4. Резюме по данным литературы – внутрипузырная химиотерапия
| Резюме по данным литературы | УД |
|---|---|
|
У пациентов с НИРМП, низкой частотой рецидива (один рецидив в год или реже) и показателем шкалы EORTC < 5 однократная немедленная внутрипузырная химиотерапия снижает частоту рецидива по сравнению с одной ТУР |
1a |
|
Однократная немедленная внутрипузырная химиотерапия влияет на частоту рецидива даже при проведении последующих сеансов химиотерапии |
3 |
|
При РМП промежуточного риска последующие сеансы внутрипузырной химиотерапии (после однократного введения химиопрепарата после ТУР или без него) улучшают безрецидивную выживаемость |
2a |
7.2.2. Внутрипузырная БЦЖ-иммунотерапия
7.2.2.1. Эффективность БЦЖ-терапии
Частота рецидива
В пяти метаанализах показано, что БЦЖ-терапия после ТУР превосходит одну ТУР или сочетание ТУР
с химиотерапией в профилактике рецидива НИРМП [218, 218, 233–236] (УД: 1a). В трех рандомизированных исследованиях, в которых сравнивали БЦЖ-терапию с комбинацией эпирубицина и интерферона [237], с MMC [238] и только с эпирубицином [219] у пациентов с опухолями промежуточного и высокого риска, подтверждено превосходство БЦЖ-терапии в отношении профилактики рецидива (УД: 1a). Влияние БЦЖ-терапии длительное [219, 238] и также выявлено в отдельном анализе пациентов с опухолями промежуточного риска [219]. В метаанализе [218] оценивали данные по 2820 пациентам, включенным в 9 рандомизированных исследований, в которых сравнивали эффективность ММС и БЦЖ-терапии. В исследованиях по поддерживающей БЦЖ-терапии отмечалось снижение риска рецидива в группе БЦЖ-терапии на 32% по сравнению с ММС, но при отсутствии поддерживающего курса наблюдалось повышение риска рецидива на 28%.
Предполагается, что для повышения эффективности ММС можно корректировать pH мочи, наряду с использованием альтернативных схем поддерживающей терапии. Ни один из этих аспектов не отражен
в цитированной выше литературе, поскольку в большинстве исследований не использовали данный подход.
Частота прогрессирования
В двух метаанализах обнаружено, что БЦЖ-терапия позволяет снизить риск или по меньшей мере отсрочить прогрессирование опухоли [216, 217, 236] (УД: 1a). В метаанализе, проведенном группой EORTCGUGC, оценивали данные 4863 больных, включенных в 24 рандомизированных исследования. Всего использовали пять разных штаммов БЦЖ, и в 20 из этих исследований проводили те или иные виды поддерживающей БЦЖ-терапии. При медиане наблюдения 2,5 года у 260 из 2658 пациентов (9,8%), получавших БЦЖ-терапию, наблюдалось прогрессирование РМП, по сравнению с 304 из 2205 (13,8%) в контрольных группах (только ТУР, ТУР + внутрипузырная химиотерапия или ТУР + другая иммунотерапия). Эти результаты свидетельствуют о снижении риска прогрессирования РМП на 27% при проведении поддерживающей БЦЖ-терапии. При этом у пациентов с папиллярными опухолями стадии Та, Т1 и карциномой in situ наблюдалось аналогичное снижение риска прогрессирования [217]. В недавно опубликованном рандомизированном исследовании с отдаленным наблюдением у больных в группе БЦЖтерапии была ниже частота развития отдаленных метастазов и выше общая и канцероспецифическая выживаемость по сравнению с внутрипузырной терапией эпирубицином [219] (УД: 1b). С другой стороны, в метаанализе данных отдельных пациентов не подтверждено статистически значимого различия между ММС и БЦЖ-терапией в отношении прогрессирования, выживаемости и причины смерти [218].
Противоречивые результаты исследований могут быть связаны с различными характеристиками пациентов, длительностью наблюдения, методологией и статистической мощностью. Однако в большинстве исследований выявлено, что БЦЖ-терапия, включая поддерживающий курс, приводит к уменьшению риска прогрессирования при опухолях высокого и промежуточного риска.
Влияние других факторов
Результаты двух других метаанализов свидетельствуют о возможных неточностях при отборе больных в группу БЦЖ-терапии, которые ранее получали внутрипузырную химиотерапию, что привело к превосходству БЦЖ-терапии [239]. Однако в самом последнем метаанализе показано, что поддерживающий курс БЦЖ-терапии более эффективен, чем ММС, вне зависимости от того, получали ли больные ранее химиотерапию [218] (УД: 1a).
Кроме того, БЦЖ-терапия менее эффективна у пациентов старше 70 лет, но при этом сохраняется ее превосходство над эпирубицином [240] (УД: 1a]. Согласно результатам когортного анализа, риск рецидива опухоли после БЦЖ-терапии выше у пациентов с раком верхних мочевыводящих путей в анамнезе [241].
7.2.2.2. Штаммы БЦЖ
В метаанализе, проведенном EORTC, не выявлено больших различий по эффективности между различными штаммами БЦЖ [241–243]. В недавно опубликованном сетевом метаанализе показано, что для внутрипузырной терапии используют 10 штаммов БЦЖ. При прямом и косвенном сравнении не выявлено различий по эффективности между различными штаммами [244].
Аналогичные результаты получены в опубликованном метаанализе проспективных рандомизированных исследований [217], недавно опубликованных результатах проспективного реестра [245], а также дополнительном анализе крупного проспективного исследования II фазы, в котором сравнивали БЦЖ-терапию и интерферон-α у пациентов, которым ранее не проводилась БЦЖ-терапия или у которых развился рецидив после БЦЖ-терапии [246] (УД: 2a). Тем не менее качество данных не позволяет сделать окончательные выводы.
7.2.2.3. Токсичность БЦЖ-терапии
После внутрипузырной БЦЖ-терапии чаще развиваются побочные эффекты по сравнению с внутрипузырной химиотерапией [217] (УД: 1a). Однако серьезные побочные эффекты наблюдаются менее чем у 5% пациентов и поддаются эффективному лечению практически во всех случаях [247] (УД: 1b). В когортном анализе реестра показано, что частота инфицирования БЦЖ после внутрипузырной терапии составляет 1% [248]. Показано, что схема поддерживающей терапии не связана с повышенным риском побочных эффектов по сравнению с индукционным курсом [247]. Побочные эффекты, которые привели к прекращению терапии, чаще развивались на первом году терапии [249]. С возрастом не возрастает частота побочных эффектов, приводящих к прекращению лечения [250] (УД: 2a). Между различными штаммами БЦЖ не выявлено различий в токсичности [245]. Симптомы могут быть следствием БЦЖ-терапии или связаны с самим заболеванием (распространенной карциномой in situ). По этой причине у значительного числа пациентов наблюдается уменьшение выраженности симптомов после завершения лечения [251].
Основные осложнения связаны с системной абсорбцией препарата. По этой причине необходимо учитывать противопоказания к внутрипузырной БЦЖ-терапии (см. раздел 7.5). Лейкоцитурия, микрогематурия или бессимптомная бактериурия не являются противопоказаниями к БЦЖтерапии, и в этих случаях не показана антибактериальная профилактика [100, 252, 253] (УД: 3).
БЦЖ-терапию следует с осторожностью применять (относительные противопоказания) у пациентов со сниженным иммунитетом (после иммуносупрессии, при наличии ВИЧ-инфекции) [254], хотя в ряде небольших исследований показана сопоставимая эффективность и частота осложнений по сравнению с пациентами с нормальным иммунным статусом. Роль профилактической противотуберкулезной терапии в таких случаях остается неясной [255–257] (УД: 3). Лечение побочных эффектов БЦЖ-терапии зависит от их типа и степени и проводится согласно рекомендациям Международной группы по раку мочевого пузыря (IBCG) и испанской группы [258, 259] (табл. 7.1).
| Варианты лечения местных побочных эффектов (модифицировано из группы IBCG) | |
|---|---|
| Симптомы цистита | Феназопиридин, пропантелина бромид или НПВС |
|
Если спустя несколько дней симптомы ослабевают: продолжать сеансы БЦЖ |
|
|
Если симптомы сохраняются или усиливаются: а. Отложить сеансы применения БЦЖ b. Провести посев мочи с. Начать эмпирическое лечение антибиотиками |
|
|
Если симптомы продолжают проявляться даже при лечении антибиотиками a. При положительном результате посева — антибиотики согласно чувствительности b. При отрицательном результате посева— хинолоны и, возможно, анальгетики и противовоспалительные в виде внутрипузырных инстилляций 1 раз в день в течение 5 дней (при необходимости повторить цикл) [223] |
|
|
Если симптомы не проходят: противотуберкулезные средства и глюкокортикоиды |
|
|
Если нет реакции на лечение и (или) отмечается сморщивание мочевого пузыря: радикальная цистэктомия |
|
|
Гематурия |
Посев мочи для исключения геморрагического цистита, если имеются другие симптомы |
|
Если сохраняется гематурия, выполнить цистоскопию для оценки наличия опухоли мочевого пузыря |
|
|
Симптоматический гранулематозный простатит |
Симптомы проявляются редко: посев мочи |
|
Хинолоны |
|
|
Если хинолоны неэффективны: изониазид (300 мг/сут) и рифампицин (600 мг/сут) в течение 3 месяцев |
|
|
Прекратить внутрипузырную терапию |
|
|
Эпидидимо орхит [224] |
Посев мочи, назначить хинолоны |
|
Прекратить внутрипузырную терапию |
|
|
Орхидэктомия при абсцессе или отсутствии ответа на лечение |
|
|
Варианты лечения в случае системных побочных эффектов |
|
|
Общее плохое самочувствие, лихорадка |
Обычно проходит самостоятельно в течение 48 часов с назначением жаропонижающих или без них |
|
Артралгия и/или артрит |
Редкое осложнение, считается аутоиммунной реакцией |
|
Артралгия: лечение НПВС |
|
|
Артрит: НПВС |
|
|
Постоянная фебрильная температура с высокой температурой (выше 38,5 °С в течение > 48 часов) |
Если ответа нет или он частичный, перейти на кортикостероиды, высокие дозы хинолонов или противотуберкулезные препараты [225] |
|
Абсолютное противопоказание к продолжению БЦЖ-терапии |
|
|
Немедленная оценка состояния: посев мочи, анализы крови, рентгенография органов грудной клетки |
|
|
Быстрое лечение более чем двумя антимикробными препаратами, пока проводится диагностическое обследование |
|
|
Консультация инфекциониста |
|
|
БЦЖ-сепсис |
Прекращение БЦЖ |
|
|
|
Аллергические реакции |
Антигистаминные и противовоспалительные препараты. |
|
Рассмотреть назначение хинолонов в высоких дозах или изониазида и рифампицина в случае сохранения симптомов. |
|
|
Отложить терапию до прекращения аллергической реакции. |
|
7.2.2.4. Оптимальный режим БЦЖ-терапии
Индукционный курс БЦЖ-терапии проводится по классической эмпирической 6-недельной схеме, предложенной Моралесом и соавт. [263]. Для оптимальной эффективности БЦЖ-терапия проводится в поддерживающем режиме [216–218, 236] (УД: 1a). Во многих исследованиях использовали поддерживающую терапию, начиная с 10 сеансов на протяжении 18 недель до 27 сеансов на протяжении трех лет [264]. В метаанализе группы EORTC авторы не смогли определить, какой из режимов поддерживающей БЦЖ-терапии был наиболее эффективным [217]. В своем метаанализе Böhle и соавт. пришли к выводу, что для получения преимущества перед ММС в профилактике рецидива или прогрессирования необходимо проводить поддерживающую терапию по меньшей мере в течение года [216] (УД: 1a).
Оптимальное количество инстилляций в индукционном цикле и оптимальная частота поддерживающих сеансов не определены. Кроме того, они могут отличаться для каждого отдельного пациента [265]. В рандоми зированных исследованиях, которые включали 1355 пациентов, группа EORTC показала, что трехлетний курс поддерживающей БЦЖ-терапии в полной дозе (три еженедельные инстилляции через 3, 6, 12, 18, 24, 30 и 36 месяцев) снижает частоту рецидивов по сравнению с курсом длительностью один год у пациентов с опухолями высокого, но не промежуточного риска. При этом отсутствовала разница в показателях прогрессирования или общей выживаемости. В группе трехлетней терапии 36,1% пациентов не завершили полную схему [266] (УД: 1b). По результатам рандомизированного исследования группы CUETO, включавшего 397 пациентов, при опухолях высокого риска поддерживающий курс с одной инстилляцией каждые три месяца не является оптимальным [267] (УД: 1b).
7.2.2.5. Оптимальная доза БЦЖ-терапии
Для уменьшения токсичности БЦЖ предлагается вводить более низкую дозу препарата. При этом показано, что при наличии мультифокальных опухолей более эффективна БЦЖ-терапия в полной дозе [268, 269] (УД: 1b). В исследовании CUETO сравнивали полную дозу и 1/3 полной дозы БЦЖ-терапии.
Результаты не показали различий в эффективности. Доза, равная 1/3 от стандартной, может быть минимально эффективной дозой для РМП промежуточного риска. Дальнейшее снижение дозы до 1/6 связано с уменьшением эффективности, при этом не наблюдается уменьшения токсичности [270] (УД: 1b).
Группа EORTC не обнаружила различий в токсичности между 1/3 и полной дозой БЦЖ-терапии, но на фоне 1/3 была выше частота рецидивов, в особенности при длительности терапии 1 год [249, 266] (УД: 1b). Кроме того, рутинное применение сниженной дозы затрудняется возможными техническими проблемами, связанными с ее правильной подготовкой.
7.2.2.6. Показания к БЦЖ-терапии
Хотя БЦЖ-терапия является очень эффективным методом лечения, достигнут консенсус о том, что ее не следует назначать всем пациентам с НИРМП в связи с риском токсичности. Решающее значение при выборе лечения имеет группа риска (табл. 6.2). Рекомендации для каждой группы риска представлены в разделе 7.5.
Заявление рабочей группы по недостаткам БЦЖ-терапии доступно по адресу :https://uroweb.org/guideline/non-muscle-invasive-bladder-cancer/?type=appendices-publications.
7.2.2.7. Резюме по данным литературы – БЦЖ-терапия
| Резюме по данным литературы | УД |
|---|---|
|
У пациентов с РМП промежуточного и высокого риска внутрипузырная БЦЖ-терапия после ТУР снижает риск рецидива и превосходит по эффективности одну ТУР или комбинацию ТУР и внутрипузырной химиотерапии |
1a |
|
Для оптимальной эффективности необходимо проводить поддерживающую БЦЖ-терапию |
1a |
|
При РМП высокого риска поддерживающая терапия длительностью три года более эффективна, чем длительностью один год, однако при опухолях промежуточного риска различия в эффективности отсутствуют |
1a |
7.2.3. Комбинированная терапия
7.2.3.1. Комбинация внутрипузырной БЦЖ-терапии и химиотерапии по сравнению с БЦЖ-терапией в режиме монотерапии
В рандомизированном контролируемом исследовании показано, что комбинация ММС и БЦЖ-терапии снижает частоту рецидивов, но обладает более высокой токсичностью по сравнению с монотерапией БЦЖ (УД: 1b). При одинаковой схеме проведения БЦЖ-терапии в обеих группах инстилляции в группе комбинированной терапии выполняли за день до введения ММС [271]. В рандомизированном исследовании, в котором сравнивали внутрипузырную химиотерапию ММС в сочетании с EMDA и комбинацию БЦЖ-терапии, ММС и EDMA, наблюдалось увеличение времени до рецидива и снижение показателей прогрессирования по сравнению с монотерапией БЦЖ [232, 272] (УД: 2). В двух метаанализах показано улучшение безрецидивной выживаемости, но выживаемость без прогрессирования была сопоставима в группе комбинированной терапии и БЦЖ-терапии в режиме монотерапии [272, 273].
7.2.3.2. Комбинированная терапия с применением интерферона
В Кокрейновском метаанализе, включавшем четыре рандомизированных исследования, в которые вошли пациенты с НИРМП и высоким риском рецидива и прогрессирования, комбинация БЦЖ-терапии и интерферона-2α не превосходит монотерапию БЦЖ по частоте рецидива и прогрессирования [274]. В другом рандомизированном исследовании обнаружено, что еженедельное введение ММС с последующей ежемесячной БЦЖ-терапией статистически значимо превосходит введение ММС с последующей ежемесячной БЦЖ-терапией и интерфероном по снижению частоты рецидива [275]. Кроме того, по данным рандомизированного исследования аналогичной популяции пациентов с НИРМП, в котором сравнивали монотерапию БЦЖ и комбинацию эпирубицина и интерферона при длительности наблюдения до двух лет, БЦЖ-терапия дает более низкую частоту рецидива [276] (УД: 1b).
7.2.4. Особенности лечения карциномы in situ
7.2.4.1. Тактика лечения
Выявление сопутствующей карциномы in situ повышает риск рецидива и прогрессирования РМП стадии Та, Т1 [174, 176], поэтому обязательно проводится дальнейшее лечение, согласно критериям, представленным в разделах 7.2.1, 7.2.2, 7.3 и 7.4. При карциноме in situ выполнение одной ТУР неэффективно.
В случае гистологического подтверждения карциномы in situ необходимо проводить дальнейшее лечение, или внутрипузырную БЦЖ-терапию, или радикальную цистэктомию (УД: 4). Хотя после ранней радикальной цистэктомии в случае карциномы in situ отмечается прекрасная канцероспецифическая выживаемость, 45–50% пациентов получают избыточное лечение [185] (УД: 3).
7.2.4.2. Когортные исследования внутрипузырной БЦЖ-терапии или химиотерапии
В ретроспективных исследованиях пациентов с карциномой in situ показатели полного ответа после внутрипузырной химиотерапии составили 48%, а после БЦЖ-терапии – 72–93% [185–188, 277] (УД: 2a).
У 50% больных с полным ответом на внутрипузырную терапию наблюдается рецидив с риском прогрессирования до инвазивного РМП и/или развития внепузырного рецидива [188, 210, 264, 277] (УД: 3).
7.2.4.3. Проспективные рандомизированные исследования внутрипузырной БЦЖ-терапии или химиотерапии
К сожалению, в литературе опубликовано всего несколько рандомизированных клинических исследований, включавших пациентов только с карциномой in situ. В метаанализе клинических испытаний, в которых сравнивали внутрипузырную БЦЖ-терапию и внутрипузырную химиотерапию у больных с карциномой in situ, в группе БЦЖ-терапии показано статистически значимое превосходство в отношении показателя ответа и уменьшение риска неэффективности лечения на 59% [278] (УД: 1a).
В метаанализе EORTC-GUCG, в котором оценивали частоту прогрессирования (подгруппа из 403 пациентов с карциномой in situ), БЦЖ-терапия снижала риск прогрессирования на 35% по сравнению с внутрипузырной химиотерапией или различными видами иммунотерапии [217] (УД: 1b). Комбинация БЦЖ-терапии и ММС не превосходит по эффективности одну БЦЖ-терапию [279]. В заключение, по сравнению с химиотерапией БЦЖ-терапия у пациентов с карциномой in situ повышает показатели полного ответа, общую пропорцию пациентов с отсутствием опухоли и уменьшает риск прогрессирования (УД: 1b).
7.2.4.4. Лечение внепузырной карциномы in situ
У пациентов с карциномой in situ повышен риск развития рака в верхних мочевыводящих путях и простатическом отделе уретры. Solsona и соавт. показали, что у 63% пациентов с карциномой in situ выявляется переходно-клеточный рак вне мочевого пузыря исходно или во время наблюдения [280]. В таких случаях выживаемость хуже, чем у пациентов с карциномой in situ только в мочевом пузыре [280] (УД: 3). В предстательной железе карцинома in situ может развиваться только в переходно-клеточном эпителии простатического отдела уретры или протоках предстательной железы [42]. Такие ситуации необходимо дифференцировать от инвазии опухоли в строму предстательной железы (РМП стадии Т4а), при которой обязательно проводится немедленная радикальная цистпростатэктомия. Пациентам с карциномой in situ в простатическом отделе уретры можно проводить внутрипузырную БЦЖ-терапию. ТУР предстательной железы позволяет улучшить контакт вакцины БЦЖ с простатическим отделом уретры [119, 281] (УД: 3). При этом следует учитывать воз можное распространение карциномы in situ; не рекомендуется использовать троакарную цистостому.
У пациентов с поражением протоков предстательной железы хорошие результаты БЦЖ-терапии показаны только в небольших исследованиях, поэтому в настоящее время недостаточно данных, чтобы сде-
лать убедительные рекомендации по тактике лечения, в связи с чем основным методом является радикальная цистэктомия [281, 282] (УД: 3).
7.2.4.5. Резюме по данным литературы – лечение карциномы in situ
| Резюме по данным литературы | УД |
|---|---|
| При карциноме in situ эндоскопического лечения недостаточно | 4 |
| По сравнению с внутрипузырной химиотерапией БЦЖ-терапия повышает частоту полного ответа, общий процент больных без рецидива и снижает риск прогрессирования опухоли |
1b |

Алгоритм 7.1. Стратегия лечения первичной или рецидивной опухоли(ей) у пациентов, которые не получали БЦЖ-терапию**
* Подробности и объяснения в тексте рекомендаций
7.3. Лечение при неэффективности внутрипузырной терапии
7.3.1. Неэффективность внутрипузырной терапии
У пациентов с рецидивом НИРМП после химиотерапии эффективна БЦЖ-терапия. Предыдущая химиотерапия не влияет на эффективность БЦЖ-терапии [218] (УД: 1a).
7.3.2. Рецидивы и неэффективность внутрипузырной БЦЖ-терапии
Предложены новые категории неэффективности внутрипузырной БЦЖ-терапии, традиционно включающей любой рецидив после лечения (табл. 7.2). Выявление НИМРП после БЦЖ-терапии можно описать как БЦЖ-рефрактерные опухоли, рецидив после БЦЖ-терапии и отсутствие ответа на БЦЖ-терапию. При рецидиве после БЦЖ-терапии прогноз лучше, чем при БЦЖ-рефрактерных опухолях [283]. Недавно предложено новое определение отсутствия ответа на БЦЖ-терапию для выделения подгруппы пациентов с более высоким риском прогрессирования, которым не показана дальнейшая БЦЖ-терапия [284]. Данное определение разработано совместно с FDA с целью сделать возможным проведение исследований без контрольной группы с частотой полного ответа и длительностью ответа в качестве первичных оцениваемых критериев. Это позволит получить данные по эффективности в поддержку регистрации новых препаратов, поскольку не разработано эффективной терапии при НИРМП и отсутствии ответа на БЦЖ-терапию [285].
| 1. Рецидив после БЦЖ-терапии |
|---|
| 1. Любой случай выявления инвазивного РМП во время наблюдения |
|
БЦЖ-рефрактерные опухоли:
|
|
Рецидив опухоли высокой степени злокачественности после БЦЖ-терапии |
| Рецидив опухоли G3/ высокой степени злокачественности (по ВОЗ 2004/1973) после завершения поддерживающего курса БЦЖ-терапии, несмотря на первоначальный ответ [247] (УД: 3) |
|
Отсутствие ответа на БЦЖ-терапию:
|
|
Непереносимость БЦЖ-терапии |
| Серьезные побочные эффекты, которые не позволяют продолжать БЦЖ-терапию до завершения индукционного курса [259] |
* Рецидив опухоли низкой степени злокачественности во время или после БЦЖ-терапии не считается неэффективностью БЦЖ-терапии.
** Адекватная БЦЖ-терапия определяется как завершение пяти из шести введений первичного индукционного курса и не менее чем два из шести введений второго индукционного курса или два из трех введений поддерживающего курса.
7.3.3. Лечение при неэффективности БЦЖ-терапии и рецидива после БЦЖ-терапии
Рекомендации по лечению представлены в табл. 7.5 и 7.7. Они отражают категории, описанные в табл. 7.2, и характеристики опухоли на момент возникновения рецидива.
У пациентов, у которых отсутствует ответ на БЦЖ-терапию, она маловероятно будет эффективна в дальнейшем; по этой причине предпочтительным вариантом лечения остается радикальная цистэктомия. Кроме того, описан ряд стратегий сохранения мочевого пузыря, которые можно разделить на такие категории, как цитотоксическая внутрипузырная химиотерапия [271], терапия с использованием дополнительных устройств (см. ниже), внутрипузырная иммунотерапия [289], системная иммунотерапия [290] или генная терапия [291–293].
В отдельных случаях при отсутствии ответа на БЦЖ-терапию данные варианты могут быть эффективны [289, 294–303] (УД: 3). В единственном рандомизированном исследовании, включавшем преимущественно пациентов с НИРМП высокого риска с неэффективностью по крайней мере предыдущего индукционного курса БЦЖ-терапии, двухлетняя безрецидивная выживаемость в группе комбинации митомицина C с микроволновой гипертермией составила 35% по сравнению с 41% в контрольной группе (проводилась БЦЖ-терапия, введение митомицина C или введение митомицина C с использованием EDMA по решению исследователя). По данным заранее спланированного анализаподгрупп, в группе митомицина C и микроволновой термотерапии была выше частота рецидива карциномы in situ, но ниже частота рецидива папиллярного РМП (24 и 53%) [304]. Недавно FDA одобрило системную иммунотерапию пембролизумабом на основании еще не опубликованных данных.
В настоящее время в случае отсутствия ответа на БЦЖ-терапию любые другие методы лечения, кроме радикальной цистэктомии, считаются онкологически менее эффективными [189, 286, 287] (УД: 3). В различных исследованиях показано, что БЦЖ-терапия подходит при рецидиве опухолей невысокой степени злокачественности и даже при некоторых рецидивных опухолях высокой степени злокачественности [294, 305] (УД: 3).
В литературе опубликовано недостаточно данных об оптимальном лечении пациентов с опухолями высокого риска, которые не смогли завершить курс БЦЖ-терапии из-за его непереносимости.
Рецидив опухоли низкой или промежуточной степени злокачественности после БЦЖ-терапии не следует расценивать как неэффективность БЦЖ-терапии. В таких случаях необходимо выбирать индивидуальную тактику, в зависимости от характеристик опухоли.
7.3.4. Резюме по данным литературы - лечение при внутрипузырномрецидиве
| Резюме по данным литературы | УД |
|---|---|
| Проведение внутрипузырной химиотерапии не влияет на эффективность БЦЖ-терапии | 1a |
| Радикальная цистэктомия превосходит по эффективности любые другие методы лечения при рецидиве после БЦЖ-терапии |
3 |
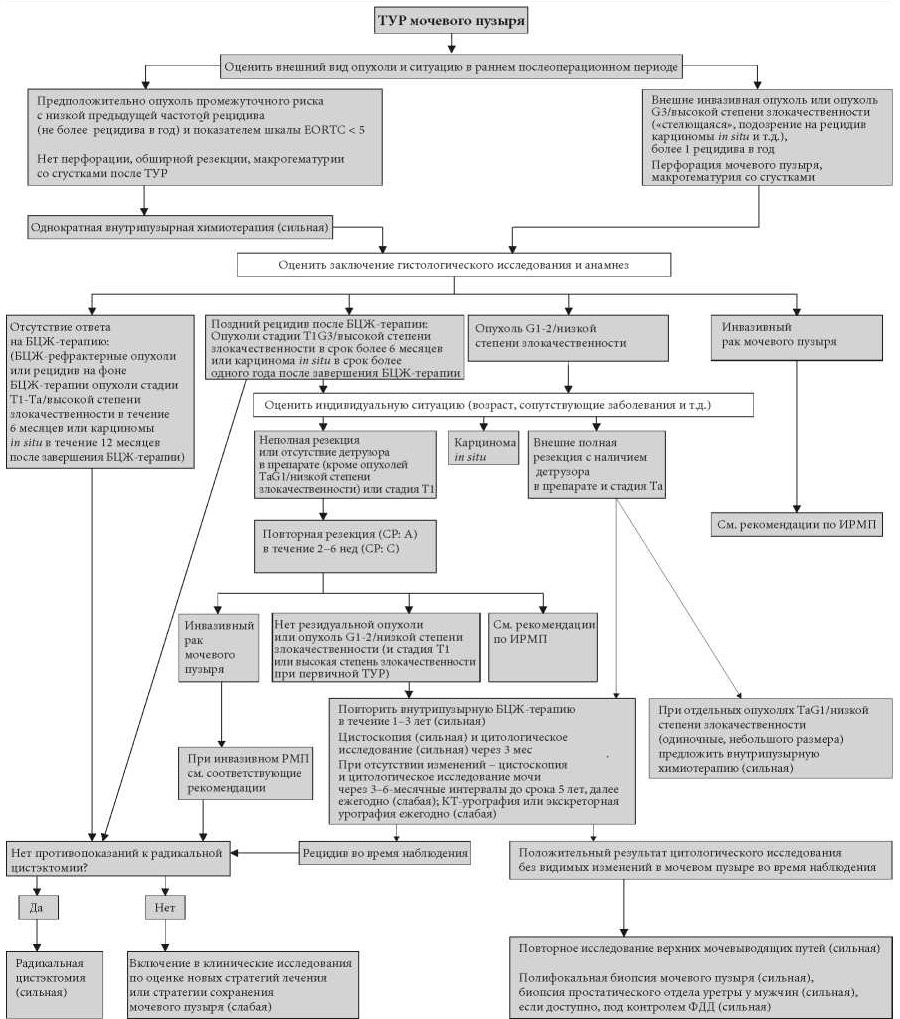
Алгоритм 7.2. Стратегия лечения при рецидиве во время или после внутрипузырной БЦЖ-терапии*
*подробности и объяснения в тексте рекомендаций
7.4. Радикальная цистэктомия при неинвазивном раке мочевого пузыря
Существует несколько причин, по которым ряду пациентов с НИРМП показана радикальная цистэктомия:
- низкая точность стадирования опухолей T1 при ТУР, и у 27–51% пациентов после ради-
кальной цистэктомии выявляется инвазивный РМП [145, 306–310] (УД: 3); - у некоторых пациентов с НИРМП развивается прогрессия до ИРМП (табл. 6.2);
- при прогрессировании неинвазивного РМП до инвазивного прогноз хуже, чем при «первичном» инвазивном РМП [311, 312].
Возможные преимущества радикальной цистэктомии необходимо взвешивать по отношению к риску, осложнениям и влиянию на качество жизни. Немедленную радикальную цистэктомию
обоснованно предлагать пациентам с НИРМП, у которых выявлен самый высокий риск прогрессирования (см. 7.6) [58, 142, 174, 176, 313] (УД: 3).
Немедленная радикальная цистэктомия настоятельно рекомендуется при отсутствии ответа на БЦЖ-терапию, как упоминалось выше. Задержка в проведении радикальной цистэктомии может привести к снижению канцероспецифической выживаемости [314] (УД: 3).
У больных, которым радикальная цистэктомия проводилась с гистологическим диагнозом
НИРМП, показатель пятилетней канцероспецифической выживаемости превышает 80% [315–317]
(УД: 3).
7.5. Рекомендации по адъювантной терапии опухолей стадии Ta, T1 и карциномы in situ
| Общие рекомендации | СР |
|---|---|
|
Курильщикам с подтвержденным НИРМП следует рекомендовать бросить курить |
Сильная |
|
Вид дальнейшей терапии после ТУР зависит от группы риска, согласно табл. 6.3 и разделу 7.6 |
Сильная |
|
Пациентам с опухолями низкого риска или опухолями промежуточного риска с низкой частотой рецидива (один рецидив в год или реже) и ожидаемым показателем рецидива по шкале EORTC < 5 рекомендуется однократная немедленная внутрипузырная химиотерапия |
Сильная |
|
Пациентам с опухолями промежуточного риска (в том числе после немедленной внутрипузырной химиотерапии) рекомендуется проводить БЦЖ-терапию в полной дозе в течение 1 года (индукционный курс + 3 еженедельные инстилляции через 3, 6 и 12 месяцев) или внутрипузырную химиотерапию (оптимальная схема неизвестна) в течение не более 1 года. Окончательный выбор зависит от индивидуального риска рецидива и прогрессирования, а также эффективности и побочных эффектов каждого метода лечения |
Сильная |
|
Пациентам с опухолями высокого риска показана внутрипузырная БЦЖ-терапия в полной дозе в течение 1-3 лет (индукционный курс + 3 еженедельные инстилляции через 3, 6, 12, 18, 24, 30 и 36 месяцев). Необходимо взвешивать дополнительный положительный эффект поддерживающей терапии на втором и третьем году с расходами, побочными эффектами и проблемами, связанными с нехваткой препаратов |
Сильная |
|
Пациентам с карциномой in situ в простатическом отделе уретры показана ТУР предстательной железы с последующей БЦЖ-терапией |
Слабая |
|
Пациентам с самым высоким риском прогрессирования (раздел 7.6) следует предлагать немедленную радикальную цистэктомию |
Сильная |
|
При отсутствии ответа на БЦЖ-терапию показана радикальная цистэктомия (см. раздел 7.7) |
Сильная |
|
При отсутствии ответа на БЦЖ-терапию и противопоказаниях к радикальной цистэктомии (вследствие сопутствующих заболеваний) рекомендуется стратегия сохранения мочевого пузыря (внутрипузырная химиотерапия, внутрипузырная химиотерапия с микроволновой гипертермией, внутрипузырная химиотерапия с использованием EDMA, внутрипузырная или системная иммунотерапия, предпочтительно в рамках клинических исследований) |
Слабая |
| Рекомендации - технические аспекты лечения | |
| Внутрипузырная химиотерапия | |
|
Если после ТУР необходимо провести однократную внутрипузырную терапию, она рекомендуется в течение 24 часов. |
Слабая |
|
Однократная немедленная внутрипузырная терапия не показана в случае выявленной/ предполагаемой внутри- или внебрюшинной перфорации (после обширной ТУР или при выраженной макрогематурии, которая требует промывания мочевого пузыря). |
Сильная |
7.6. Рекомендации по лечению опухолей стадии Ta, T1 и карциномы in situ в зависимости от группы риска
| Категория риска | Определение | Рекомендации по лечению |
|---|---|---|
|
Опухоли низкого риска |
Первичные, одиночные опухоли стадии Та, низкой степени злокачественности/Gl, PUNLMP, размером < 3 см, без карциномы in situ |
Однократная немедленная внутрипузырная химиотерапия после ТУР |
|
Опухоли промежуточного риска |
Все случаи, не попадающие в категорию низкого или высокого риска |
Пациентам с низкой частотой рецидива (один рецидив в год или реже) и ожидаемым показателем рецидива по шкале EORTC <5 рекомендуется однократная немедленная внутрипузырная химиотерапия после ТУР. Всем пациентам БЦЖ-терапия в полной дозе (индукционный курс + 3 еженедельных инстилляции через 3, 6 и 12 мес) или внутрипузырная химиотерапия (оптимальная схема неизвестна) в течение не более 1 года |
|
Опухоли высокого риска |
Любые из указанных ниже:
|
Внутрипузырная БЦЖ-терапия в полной дозе в течение 1-3 лет или цистэктомия (при опухолях самого высокого риска - см. ниже) |
|
Подгруппа опухолей самого высокого риска |
||
|
ТЮ3/высокой степени злокачественности с сопутствующей карциномой in situ мочевого пузыря, множественные и/или рецидивные опухоли T1G3 и/или крупные опухоли T1G3, T1G3 в сочетании с карциномой in situ в простатическом отделе уретре, некоторые гистологические варианты, лимфососудистая инвазия (см. разделы 4.7 и 6.4 |
Следует рассмотреть выполнение радикальной цистэктомии. Если пациент отказывается или имеет противопоказания к радикальной цистэктомии, показана БЦЖ-терапия в полной дозе в течение 1-3 лет |
|
7.7. Рекомендации по лечению больных с неэффективностью БЦЖ-терапии
| Категория | Рекомендации по лечению | СР |
|---|---|---|
|
Отсутствие ответа на БЦЖ-терапию |
1. Радикальная цистэктомия |
Сильная |
|
2. Включение в клинические исследования по оценке новых стратегий лечения |
Слабая |
|
|
3. Стратегии сохранения мочевого пузыря у пациентов, которые не подходят или отказываются от цистэктомии |
Слабая |
|
|
Рецидив опухоли стадии Tl-Ta/высокой степени злокачественности в срок более 6 месяцев или карцинома in situ в срок более года после завершения БЦЖ-терапии |
1. Радикальная цистэктомия или повторный курс БЦЖ-терапии в зависимости от индивидуальной ситуации |
Сильная |
|
2. Стратегии сохранения мочевого пузыря |
Слабая |
|
|
Рецидив после БЦЖ-терапии низкой степени злокачественности после лечения первичной опухоли промежуточного риска |
1. Повторный курс БЦЖ-терапии или химиотерапии |
Слабая |
|
2. Радикальная цистэктомия |
Слабая |
8. Наблюдение за пациентами с неинвазивным раком мочевого пузыря
Из-за риска рецидива и прогрессирования пациентам с НИРМП необходимо проводить регулярное обследование после лечения. Однако частота выполнения цистоскопии и методов визуализации и длительность периода наблюдения должны соответствовать индивидуальному риску. Используя таблицы риска (табл. 6.1 и 6.2), можно прогнозировать ближайший и отдаленный риск рецидива и прогрессирования у отдельных пациентов и соответствующим образом определить схему наблюдения (см. раздел 8.1) [174, 176]. Следует отметить, что рекомендации по наблюдению основаны преимущественно на результатах ретроспективных исследований и в литературе отсутствует достаточное количество рандомизированных исследований, в которых бы оценивали возможность безопасного уменьшения частоты цистоскопии.
При планировании схемы наблюдения и методов необходимо учитывать следующие аспекты.
- Своевременное выявление ИРМП и рецидива НИРМП G3/высокой степени злокачественности имеет крайне важное значение, поскольку задержка в диагностике и лечении может представлять угрозу для жизни.
- Рецидив РМП группы низкого риска почти всегда имеет низкую стадию и G1/низкую степень злокачественности. Небольшие неинвазивные (Та) папиллярные опухоли G1/низкой степени злокачественности не создают немедленную опасность для пациента, и их раннее выявление не является существенно важным для успешного лечения [318, 319] (УД: 2b). Хорошим и безопасным методом для снижения травматичности лечения является амбулаторное прижигание (фульгурация) небольших папиллярных рецидивных опухолей [320] (УД: 3). Многие авторы рекомендуют в отдельных случаях временное активное наблюдение [321–323] (УД: 3).
- Первая цистоскопия через 3 месяца после ТУР является очень важным прогностическим фактором рецидива и прогрессирования [182, 189, 324–326] (УД: 1a). Всем пациентам с РМП стадии Та, Т1 и карциномой in situ обязательно необходимо провести первую цистоскопию через 3 месяца после ТУР.• Риск рецидива у больных с РМП низкого риска после пятилетнего периода без рецидива мал [325] (УД: 3). В таких случаях можно отказаться от цистоскопии или заменить ее менее инвазивными методами через 5 лет наблюдения [326].
- У больных с РМП промежуточного и высокого риска рецидивы после десятилетнего периода без рецидива не являются необычным [327] (УД: 3). Следовательно, рекомендуется пожизненное наблюдение [326].
- При определении схемы наблюдения необходимо учитывать риск внепузырного рецидива (простатический отдел уретры у мужчин и верхние мочевыводящие пути у лиц обоих полов).
- Риск рецидива в верхних мочевыводящих путях увеличивается в случае множественных опухолей и опухолей с высокой степенью злокачественности [77] (УД: 3).
- Положительный результат исследования мочи оказывает положительное влияние на качество контрольной цистоскопии [116] (УД: 1b), что подтверждает вспомогательную роль исследования мочи во время наблюдения.
- При первичном диагнозе РМП стадии Ta/G1-2/низкой степени злокачественности и невозможности/отказе пациента от проведения цистоскопии можно выполнять УЗИ мочевого пузыря [328].
- В настоящее время нет неинвазивных методик, которые могли бы заменить цистоскопию.
8.1. Резюме по данным литературы и рекомендации по наблюдению пациентов с неинвзивным раком мочевого пузыря
| Резюме по данным литературы | УД |
|---|---|
|
Первая цистоскопия через 3 месяца после ТУР является важным прогностическим фактором рецидива и прогрессирования |
1a |
|
Риск рецидива в верхних мочевыводящих путях увеличивается в случае множественных опухолей и опухолей с высокой степенью злокачественности |
3 |
| Рекомендации | СР |
|---|---|
|
Контрольное обследование при РМП стадии Та, Т1 и карциноме in situ основано на регулярной цистоскопии |
Сильная |
|
Пациентам с РМП низкого риска стадии Ta необходимо выполнять цистоскопию через 3 месяца после операции. При отсутствии рецидива следующую цистоскопию рекомендуется проводить через 9 месяцев, а затем ежегодно на протяжении 5 лет |
Слабая |
|
Пациентам с РМП высокого риска необходимо выполнять цистоскопию и цитологическое исследование мочи через 3 месяца после операции. При отсутствии рецидива следующая цистоскопия и цитологическое исследование должны проводиться через каждые 3 месяца в течение 2 лет, а затем каждые 6 месяцев до достижения пятилетнего периода, после этого - ежегодно |
Слабая |
|
Схема наблюдения пациентов с РМП промежуточного риска стадии Ta включает цистоскопию и цитологическое исследование, частота которых определяется индивидуально |
Слабая |
|
При РМП высокого риска необходимо регулярно (ежегодно) проводить визуализацию верхних мочевыводящих путей (КТ-урография или экскреторная урография) |
Слабая |
|
При выявлении изменений на амбулаторной цистоскопии или положительном результате цитологического исследования необходимо выполнить цистоскопию под анестезией с биопсией мочевого пузыря |
Сильная |
|
При положительном результате цитологического исследования мочи и отсутствии видимых изменений в мочевом пузыре рекомендуется выполнить мультифокальную биопсию или биопсию с ФДД (если имеется такое оборудование) и исключить переходно-клеточный рак внепузырной локализации (КТ-урография, биопсия простатического отдела уретры) |
Сильная |
|
При первичном диагнозе РМП стадии Ta/Gl-2/низкой степени злокачественности и невозможности/отказе пациента от проведения цистоскопии можно выполнять УЗИ мочевого пузыря |
Слабая |
9. Литература (представлена в конце издания)
10. Конфликт интересов
Все члены группы по составлению клинических рекомендаций по НИРМП предоставили открытый отчет по всем взаимоотношениям, которые они имеют и которые могут быть восприняты как причина конфликта интересов. Эта информация доступна на сайте Европейской ассоциации урологов: https://uroweb.org/guideline/non-muscle-invasive-bladder-cancer/?type=panel..
Данные рекомендации были созданы при финансовой поддержке ЕАУ. При этом не использовались внешние источники финансирования и поддержки. ЕАУ – некоммерческая организация, финансовые издержки которой ограничиваются административными расходами, а также оплатой поездок и встреч. Авторам рекомендаций ЕАУ не предоставляла гонораров или какой-либо другой компенсации.
11. Информация по цитированию
Формат, по которому необходимо цитировать рекомендации ЕАУ, варьирует в зависимости от типа журнала. Соответственно может отличаться количество авторов или, например, данные об издателе, местоположении или номере ISBN.
Ссылка на полную версию рекомендаций оформляется следующим образом: EAU Guidelines. Edn. presented at the EAU Annual Congress, Amsterdam, the Netherlands, 2020.
ISBN 978-94-92671-07-3.
Если требуется издатель и/или местоположение:
EAU Guidelines Office, Arnhem, The Netherlands. http://uroweb.org/guidelines/compilations-of-all-guidelines/
Ссылки на отдельные рекомендации оформляются следующим образом:
Имена авторов. Название источника. Тип публикации. ISBN. Издатель и его местоположение, год.