M. Rouprêt, M. Babjuk (председатель), M. Burger (вице-председатель), E. Compérat, N.C. Cowan, P. Gontero, A.H. Mostafid, J. Palou,
B.W.G. van Rhijn, S.F. Shariat, R. Sylvester, R. Zigeuner
Помощники в написании рекомендаций: O. Capoun, D. Cohen,
J.L. Dominguez-Escrig, B. Peyronnet, T. Seisen, V. Soukup
Перевод: Ширанов К.А.
Научное редактирование:
© Европейская ассоциация урологов, 2020
СОДЕРЖАНИЕ
- 1. ВВЕДЕНИЕ
- 1.1. Цели и задачи
- 1.2. Состав рабочей группы
- 1.3. Доступные публикации
- 1.4. История публикаций и резюме по изменениям
- 2. МЕТОДЫ
- 2.1. Поиск данных
- 2.2. Рецензирование
- 3. ЭПИДЕМИОЛОГИЯ, ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
- 3.1. Эпидемиология
- 3.2. Факторы риска
- 3.3. Гистология и классификация
- 3.3.1. Гистологические типы
- 3.4. Резюме по данным литературы и рекомендации по эпидемиологии, этиологии и патогенезу
- 4. СТАДИРОВАНИЕ И КЛАССИФИКАЦИЯ
- 4.1. Классификация
- 4.2. TNM-классификация
- 4.3. Степень злокачественности
- 4.4. Направления для дальнейшего развития
- 5. ДИАГНОСТИКА
- 5.1. Клинические симптомы
- 5.2. Методы визуализации
- 5.2.1. Компьютерная томография с контрастированием
- 5.2.2. Магнитно-резонансная томография
- 5.3. Цистоскопия и цитологическое исследование мочи
- 5.4. Диагностическая уретероскопия
- 5.5. Отдаленные метастазы
- 5.6. Резюме по данным литературы и рекомендации по диагностике переходно-клеточного рака верхних мочевыводящих путей
- 6. ПРОГНОЗ
- 6.1. Прогностические факторы
- 6.2. Предоперационные факторы
- 6.2.1. Возраст и пол
- 6.2.2. Этническое происхождение
- 6.2.3. Курение табака
- 6.2.4. Локализация, мультифокальность, размер опухоли и гидронефроз
- 6.2.5. Задержка хирургического лечения
- 6.2.6. Другие факторы
- 6.3. Послеоперационные факторы
- 6.3.1. Стадия и степень злокачественности опухоли
- 6.3.2. Поражение лимфоузлов
- 6.3.3. Лимфососудистая инвазия
- 6.3.4. Хирургический край
- 6.3.5. Патоморфологические факторы
- 6.4. Молекулярные маркеры
- 6.5. Прогностические инструменты
- 6.5.1. Внутрипузырный рецидив
- 6.6. Стратификация риска неметастатического рака верхних мочевыводящих путей
- 6.7. Резюме по данным литературы и рекомендации по прогнозу
- 7. ЛЕЧЕНИЕ
- 7.1. Локализованный рак
- 7.1.1. Органосохраняющее лечение
- 7.1.1.1. Уретероскопия
- 7.1.1.2. Чрескожный доступ
- 7.1.1.3. Сегментарная резекция мочеточника
- 7.1.1.4. Адъювантная местная терапия
- 7.1.1.5. Рекомендации по органосохраняющему лечению переходно-клеточного рака верхних мочевыводящих путей
- 7.1.2. Радикальная нефруретерэктомия
- 7.1.2.1. Хирургический доступ
- 7.1.3. Периоперационная химиотерапия в качестве дополнения к радикальной нефруретерэктомии
- 7.1.3.1. Неоадъювантная химиотерапия
- 7.1.3.2. Адъювантная химиотерапия
- 7.1.4. Адъювантная лучевая терапия после радикальной нефруретерэктомии
- 7.1.5. Адъювантная внутрипузырная химиотерапия
- 7.1.6. Резюме по данным литературы и рекомендации по лечению неметастатического рака верхних мочевыводящих путей высокого риска
- 7.1.1. Органосохраняющее лечение
- 7.2. Метастатическая болезнь
- 7.2.1. Радикальная нефруретерэктомия
- 7.2.2. Метастазэктомия
- 7.2.3. Системная химиотерапия
- 7.2.3.1. Первая линия терапии
- 7.2.3.2. Вторая линия терапии
- 7.2.4. Резюме по данным литературы и рекомендации по лечению метастатического переходно-клеточного рака ВМП
- 7.1. Локализованный рак
- 8. НАБЛЮДЕНИЕ
- 8.1. Резюме по данным литературы и рекомендации по наблюдению переходно-клеточного рака верхних мочевыводящих путей
- 9. ЛИТЕРАТУРА
- 10. КОНФЛИКТ ИНТЕРЕСОВ
- 11. ИНФОРМАЦИЯ ПО ЦИТИРОВАНИЮ
1. Введение
1.1. Цели и задачи
Рабочая группа Европейской ассоциации урологов (ЕАУ) по неинвазивному раку мочевого пузыря (НИРМП) подготовила настоящие рекомендации, чтобы дать урологам научную информацию и практические рекомендации по клиническому лечению переходно-клеточного рака верхних мочевыводящих путей (ВМП). Кроме того, доступны отдельные рекомендации ЕАУ по неинвазивному раку мочевого пузыря [1], инвазивному и метастатическому раку мочевого пузыря [2] и первичному раку уретры [3].
Необходимо подчеркнуть, что клинические рекомендации включают наиболее качественные данные, доступные в настоящее время экспертам. Однако следование рекомендациям не всегда приведет к оптимальному результату. Клинические рекомендации никогда не заменят клинический опыт при определении тактики лечения конкретного пациента, а скорее помогут направить ее с учетом персональных данных и предпочтений/конкретной ситуации больного. Рекомендации не являются обязательными для соблюдения и не рассматриваются как юридический стандарт оказания помощи.
1.2. Состав рабочей группы
Рабочая группа ЕАУ по НИРМП состоит из международной многопрофильной команды экспертов, включая уролога, онкоуролога, специалиста по лучевой диагностике, морфолога и статистика. Члены рабочей группы выбраны на основании их опыта, чтобы представлять специалистов, занимающихся лечением пациентов с подозрением на переходно-клеточный рак. Все эксперты, которые принимали участие в создании документа, направили заявление о возможном конфликте интересов, которое можно посмотреть на сайте ЕАУ: http://uroweb.org/guideline/upper-urinary-tract-urothelial-cell-carcinoma/.
1.3. Доступные публикации
Доступны краткие рекомендации как в печатном виде, так и в различных версиях для мобильных устройств на базе iOS и Android, в которых представлены основные данные из рекомендаций по раку ВМП. Это сокращенные версии, которые требуют обращения к полному тексту рекомендаций. Опубликован ряд научных статей, а также несколько переводов всех версий рекомендаций. Последняя научная статья опубликована в 2018 г. [4]. Все документы доступны на сайте ЕАУ:
http://uroweb.org/guideline/upper-urinary-tract-urothelial-cell-carcinoma/.
1.4. История публикаций и резюме по изменениям
Первые рекомендации ЕАУ по раку ВМП были опубликованы в 2011 г. Настоящее печатное издание представляет собой значительное обновление рекомендаций 2019 г. 1.4.1. Резюме по изменениям Во всем документе проведен анализ и пересмотр литературы, если это имело значение.
Во всем документе добавлены и перефразированы резюме по данным литературы и рекомендации.
Основные изменения в настоящих рекомендациях:
- Раздел 3.1 «Эпидемиология» расширен, изменен рис. 3.1 и добавлены две новые рекомендации.
3.4. Резюме по данным литературы и рекомендации по эпидемиологии, этиологии и патогенезу
| Резюме по данным литературы | УД |
|---|---|
|
Аристолохиевая кислота и курение повышают риск развития рака ВМП |
2 |
|
У пациентов с синдромом Линча повышен риск развития рака ВМП |
3 |
| Рекомендации | СР |
|---|---|
| Для выявления пациентов с переходно-клеточным раком ВМП необходимо оценивать личный и семейный анамнез на основании Амстердамских критериев | Слабая |
|
Необходимо оценивать влияние курения и воздействие аристолохиевой кислоты |
Слабая |
• Глава 6 «Прогноз»: добавлены информация и рекомендация, а также изменен рис. 6.1.
6.7. Резюме по данным литературы и рекомендации по прогнозу
| Резюме по данным литературы | УД |
|---|---|
|
Возраст не является исключающим фактором для выполнения РНУ, если операция показана в качестве радикального метода лечения |
3 |
|
Основные послеоперационные прогностические факторы включают гидронефроз, мультифокальность, размер, стадию и степень злокачественности опухоли, метастазы в лимфоузлы, лимфососудистую инвазию и редкие гистологические варианты |
3 |
| Рекомендации | СР |
|---|---|
|
Необходимо использовать предоперационные факторы для стратификации риска и определения тактики лечения |
Слабая |
• Раздел 7 «Лечение» реструктурирован, включена новая информация по адъювантной и неоадъю-
вантной химиотерапии. Кроме того, адаптированы рис. 7.1 и 7.2 и добавлены новые рекомендации.
7.1.6. Резюме по данным литературы и рекомендации по лечению неметастатического рака верхних мочевыводящих путей высокого риска
| Резюме по данным литературы | УД |
|---|---|
|
Неполное удаление стенки мочевого пузыря в области устья мочеточника повышает риск внутрипузырного рецидива |
3 |
|
Лимфодиссекция повышает выживаемость при инвазивном переходно-клеточном раке ВМП |
3 |
|
Периоперационная химиотерапия повышает выживаемость |
3 |
|
Однократная внутрипузырная химиотерапия в послеоперационном периоде снижает риск внутрипузырного рецидива |
1 |
| Рекомендации | СР< |
|---|---|
|
РНУ показана при неметастатическом переходно-клеточном раке ВМП высокого риска |
Сильная |
|
При нелокализованном переходно-клеточном раке ВМП показана открытая РНУ |
Слабая |
|
Необходимо полностью резецировать стенку мочевого пузыря в области устья мочеточника |
Сильная |
|
При переходно-клеточном раке ВМП высокого риска показана лимфодиссекция по анатомическим шаблонам |
Сильная |
|
При инвазивном переходно-клеточном раке ВМП показана периоперационная химиотерапия |
Слабая |
|
Послеоперационная внутрипузырная химиотерапия снижает риск внутрипузырного рецидива |
Сильная |
• Раздел 7.2 «Метастатическая болезнь» расширен, добавлена последняя информация по иммунотерапии в рамках первой и второй линий химиотерапии. Добавлено резюме по данным
литературы и рекомендации по лечению метастатического переходно-клеточного рака ВМП.
7.2.4. Резюме по данным литературы и рекомендации по лечению метастатического переходно-клеточного рака ВМП
| Резюме по данным литературы | УД |
|---|---|
|
РНУ у отдельных пациентов с метастатическим раком позволяет улучшить качество жизни и онкологические результаты |
3 |
|
Комбинированная химиотерапия на основе цисплатина позволяет повысить медиану выживаемости |
2 |
|
Монохимиотерапия и комбинированная химиотерапия на основе карбоплатина уступают по эффективности комбинированной химиотерапии на основе цисплатина в отношении частоты полного ответа и выживаемости |
3 |
|
Комбинированную химиотерапию без препаратов платины не сравнивали со стандартной химиотерапией у пациентов с или без противопоказаний к комбинированной химиотерапии на основе цисплатина |
4 |
|
По результатам исследования III фазы, ингибитор PD-1 пембролизумаб одобрен к применению у пациентов с прогрессированием рака во время или после комбинированной химиотерапии на основе препаратов платины |
1b |
|
По результатам исследования II фазы, ингибитор PD-L1 атезолизумаб одобрен к применению у пациентов с прогрессированием рака во время или после комбинированной химиотерапии на основе препаратов платины |
2a |
|
По результатам исследования II фазы, ингибитор PD-1 ниволумаб одобрен к применению у пациентов с прогрессированием рака во время или после комбинированной химиотерапии на основе препаратов платины |
2a |
|
По результатам исследования III фазы, ингибитор PD-1 пембролизумаб одобрен к применению у пациентов с распространенным или метастатическим переходно-клеточным раком с противопоказаниями к первой линии комбинированной химиотерапии на основе препаратов платины, однако его можно использовать только при наличии экспрессии PD-L1 |
2a |
|
По результатам исследования III фазы, ингибитор PD-L1 атезолизумаб одобрен к применению у пациентов с распространенным или метастатическим переходно-клеточным раком с противопоказаниями к первой линии комбинированной химиотерапии на основе препаратов платины, однако его можно использовать только при наличии экспрессии PD-L1 |
2a |
| Рекомендации | СРh |
|---|---|
|
РНУ показана в качестве паллиативного лечения пациентам с симптоматическим операбельным местнораспространенным раком ВМП |
Слабая |
|
Препараты первой линии для пациентов без противопоказаний к цисплатину |
|
|
Химиотерапия на основе препаратов платины включает схемы GC, MVAC, предпочтительно с Г-КСФ, высокодозный режим MVAC с Г-КСФ или PCG |
Сильная |
|
Карбоплатин и комбинированная химиотерапия без препаратов платины не показаны |
Сильная |
|
Препараты первой линии для пациентов с противопоказаниями к цисплатину |
|
|
Ингибиторы иммунных контрольных точек (пембролизумаб или атезолизумаб) необходимо назначать в зависимости от экспрессии PD-L1 |
Слабая |
|
При отсутствии экспрессии PD-L1 показана комбинированная химиотерапия на основе карбоплатина |
Сильная |
|
Препараты второй линии |
|
|
Ингибитор иммунных контрольных точек (пембролизумаб) показан пациентам с прогрессированием метастатического рака во время или после комбинированной химиотерапии на основе препаратов платины |
Сильная |
|
Ингибитор иммунных контрольных точек (атезолизумаб) показан пациентам с прогрессированием метастатического рака во время или после комбинированной химиотерапии на основе препаратов платины |
Сильная |
|
Винфлунин показан только пациентам с метастатическим раком в качестве препарата второй линии, если нельзя провести иммунотерапию или комбинированную химиотерапию. Кроме того, винфлунин можно использовать в рамках третьей или последующих линий терапии |
Сильная |
2. Методы
2.1. Поиск данных
Стандартная процедура для рабочей группы ЕАУ по рекомендациям включает ежегодную оценку новой опубликованной литературы, на основании чего проводятся последующие обновления.
В клинических рекомендациях 2020 г. по раку ВМП посредством структурированного литературного поиска найдены, сопоставлены и оценены новые и клинически значимые данные. Поиск был ограничен с 20 июня (база Кокрейновских обзоров)/26 июня (Embase) 2018 г. до 31 мая 2019 г. Поиск проводился в базе данных Pubmed, Ovid, EMBASE и центральном реестре и базе данных Кокрейновских систематических обзоров. После дедубликации найдены и проанализированы 702 статьи.
Из полученных статей исключены базовые исследования, серии случаев, отчеты и комментарии редакторов. Включены только исследования взрослых пациентов, результаты которых опубликованы на английском языке. Найденные публикации в основном имели ретроспективный характер, включая ряд крупных многоцентровых исследований. Вследствие недостаточного количества рандомизированных данных статьи отбирались по следующим критериям: развитие концепции, промежуточные и отдаленные клинические результаты, качество и важность исследований.
Всего 56 статей включены в обновление настоящих рекомендаций. Старые исследования включали, только если они имели историческое значение. Поисковая стратегия опубликована по адресу:
http://uroweb.org/guideline/upper-urinary-tract-urothelial-cell-carcinoma/?type=appendices-publications.
В разделах 3–6 («Эпидемиология, этиология и патогенез», «Стадирование и классификация», «Диагностика и прогноз») литература оценивалась по уровню доказательности (УД), а рекомендации градировали по степени (СР) согласно классификации Оксфордского центра медицинских исследований, основанной на доказательствах [5]. В разделах 7 и 8 («Лечение» и «Наблюдение») использовали систему, модифицированную из классификации Оксфордского центра медицинских исследований, основанной на доказательствах, 2009 г. [5].
Для каждой рекомендации в онлайн-режиме заполняется форма для определения силы, с учетом ряда основных элементов, на основании модифицированной методологии GRADE [6, 7].
Сила рекомендаций определяется с учетом следующих основных элементов:
- общее качество данных в поддержку рекомендаций; ссылки, используемые в этом тексте, градируются по степени согласно системе, модифицированной из классификации Оксфордского центра медицинских исследований, основанной на доказательствах (см. выше) [5];
- выраженность эффекта (индивидуальный или комбинированный эффект);
- убедительность результатов (точность, согласованность, неоднородность и другие статистические или связанные с исследованиями факторы);
- баланс между желательными и нежелательными исходами;
- влияние ценностей и предпочтений пациента на вмешательство;
- точность этих ценностей и предпочтений пациента.
Эти основные элементы стали основой, которую рабочая группа использует для определения силы каждой рекомендации. Она в свою очередь описана терминами «сильная» или «слабая». Сила каждой рекомендации определяется балансом между желательными и нежелательными последствиями альтернативных стратегий, качеством данных (включая точность критериев) и природой и вариабельностью ценностей и предпочтений пациентов [8]. С целью консультирования таблицы опубликованы онлайн.
Дополнительную информацию по методологии можно найти в общем разделе «Методология» настоящего печатного издания или в онлайн-версии на сайте ЕАУ: http://www.uroweb.org/guideline/. По указанному адресу также можно просмотреть список ассоциаций, которые оказали поддержку в составлении рекомендаций ЕАУ.
2.2. Рецензирование
Рекомендации прошли рецензирование перед публикацией в 2016 г. Обзорная статья была прорецензирована перед публикацией в 2018 г. [4].
3. Эпидемиология, этиология и патогенез
3.1. Эпидемиология
В развитых странах переходно-клеточный рак занимает 4-е место по распространенности [9]. Он может развиваться как в нижних (в мочевом пузыре или уретре), так и в верхних мочевыводящих путях (ВМП) (в чашечно-лоханочной системе или мочеточнике). Рак мочевого пузыря (РМП) составляет 90–95% всех случаев переходно-клеточного рака и является наиболее распространенной злокачественной опухолью мочевыводящих путей [1]. Переходно-клеточный рак ВМП встречается довольно редко и составляет 5–10% всех случаев переходно-клеточного рака [9] с установленными ежегодными показателями в западных странах почти 2 случая на 100 000 населения. Эти показатели увеличились за последние несколько десятилетий в результате улучшения диагностики и повышения выживаемости пациентов с РМП [10].
Опухоли чашечно-лоханочной системы почки встречаются в 2 раза чаще, чем опухоли мочеточника, а многофокусные опухоли наблюдаются в 10–20% случаев [11]. У 11–36% пациентов выявляется сопутствующая карцинома in situ [10], а в 17% случаев одновременно диагностируется РМП [12]. У 41% мужчин в Америке в анамнезе имеется РМП по сравнению с 4% мужчин в Китае [13]. Этим, наряду с генетическими и эпигенетическими факторами, можно объяснить, почему у пациентов в Азии при первичной диагностике рак имеет более высокую стадию и степень злокачественности по сравнению с другими этническими группами [10].
Рецидив в мочевом пузыре встречается у 22–47% пациентов с раком ВМП [14], а рецидив с контралатеральной стороны – только в 2–6% случаев [15].
В исследовании, включавшем 82 пациента с РМП, которым через 1–3 года после БЦЖ-терапии проводилась визуализация ВМП, частота переходно-клеточного рака составила 13%. Все случаи были бессимптомными [16]. В другом исследовании (n = 307) без рутинной визуализации ВМП частота рака составила 25% [17]. В многоцентровом когортном исследовании (n = 402) с длительностью наблюдения 50 месяцев переходно-клеточный рак ВМП выявлен у 7,5% пациентов с неинвазивным РМП, которым проводилась БЦЖ-терапия. Прогностическими факторами были внутрипузырный рецидив и непапиллярный характер роста опухоли во время трансуретральной резекции [16]. После радикальной цистэктомии, выполненной по поводу инвазивного РМП, у 3–5% больных развивается метахронный переходно-клеточный рак ВМП.
Около 60% переходно-клеточных опухолей ВМП являются инвазивными на момент диагностики по сравнению с 15–25% при РМП [18], а у 7% пациентов выявляются метастазы [10, 19].
Пик заболеваемости приходится на возраст от 70 до 90 лет, и у мужчин эти опухоли встречаются втрое чаще, чем у женщин [20].
При переходно-клеточном раке ВМП и РМП имеются сильные различия по частоте основных геномных нарушений. У пациентов с обоими раками в анамнезе они всегда развиваются из одного клона клеток. Анализ геномных нарушений при переходно-клеточном раке ВМП дает информацию о риске внутрипузырного рецидива и позволяет выявить опухоли, связанные с синдромом Линча [21].
Амстердамские критерии представляют собой диагностические критерии, используемые для выявления семей с вероятным наличием синдрома Линча [22]. При переходно-клеточном раке ВМП, связанном с синдромом Линча, иммуногистохимический анализ в 98% случаев показывает отсутствие экспрессии белков, предрасполагающей к мутации генов, ответственных за ошибки репарации ДНК (46% с микросателлитной нестабильностью и 54% с микросателлитной стабильностью) [23]. Большинство опухолей развиваются у носителей мутации MSH2 [24]. Пациентам с высоким риском синдрома Линча необходимо провести секвенирование ДНК и консультированиеродственников [25, 26]. Характерные для синдрома Линча наследственные мутации в ДНК генов,ответственных за ошибки репарации ДНК, определяются у 9% пациентов с переходно-клеточнымраком ВМП по сравнению с 1% больных РМП, что свидетельствует о связи переходнолеточного рака ВМП и синдрома Линча [27]. В исследовании, включавшем 115 последовательных пациентов с переходно-клеточным раком ВМП, результат скрининга на синдром Линча был положительным в 13,9% случаев, а в 5,2% случаев синдром был подтвержден [28]. Это один из наиболее высоких показателей невыявленного генетического заболевания при урологических опухолях, который оправдывает скрининг всех пациентов с переходно-клеточным раком ВМП младше 65 лет и больных с отягощенным семейным анамнезом (см. рис. 3.1) [29, 30].

Рис. 3.1. Отбор пациентов с раком верхних мочевыводящих путей на скрининг наследственных форм во время первичного сбора анамнеза
3.2. Факторы риска
Существует большое количество факторов окружающей среды, способствующих развитию перероли данных факторов, за исключением курения и аристолохиевой кислоты. Курение табака увеличивает риск развития переходно-клеточного рака ВМП в 2,5–7 раз [32–34]. В крупном популяционном исследовании, включавшем 229 251 «случай» и 1 197 552 подобранных «контроля», в котором оценивали семейные случаи переходно-клеточного рака, выявлены генетические или связанные с окружающей средой факторы, независимо от статуса курения. Хотя более чем у 9% участников диагностирован переходно-клеточный рак ВМП, семейных случаев не определялось, что может свидетельствовать о наличии семейных случаев только при переходно-клеточном раке нижних мочевыводящих путей [35].
На Тайване наличие мышьяка в питьевой воде связано с переходно-клеточным раком ВМП [36]. Аристолохиевая кислота, нитрофенантрен-карболовая кислота, выделяемая из растения Aristolochia, оказывает различные эффекты на мочевыводящую систему. Аристолохиевая кислотанеобратимо повреждает проксимальные канальцы, приводя к хроническим тубулоинтерстици альным заболеваниям, а мутагенные свойства аристолохиевой кислоты преимущественно приводят к переходно-клеточному раку ВМП [37–39]. Недавно описана связь аристолохиевой кислоты с РМП, почечно-клеточным раком, печеночно-клеточным раком и внутрипеченочной холангиокарциномой [40]. Описано два пути воздействия аристолохиевой кислоты: (i) загрязнения сельскохозяйственных культур растениями Aristolochia, как описано при балканской эндемической нефропатии [41]; и (ii) употребление лекарственных трав на основе Aristolochia [42, 43]. Препаратырастения Aristolochia используются по всему миру, особенно в Китае и на Тайване [39]. После биологической активации аристолохиевая кислота воздействует на геномную ДНК с формированием аддуктов деоксиаденозин-аристолактама [44]; данные изменения сохраняются в тканях-мишенях на протяжении десятилетий, выступая в роли достоверных биомаркеров воздействия [9]. Аддукты создают уникальный спектр мутаций, характеризующийся трансверсиями A→T, локализующимися преимущественно на нетранскрибируемом участке ДНК [40, 45]. Переходно-клеточный рак ВМП развивается менее чем у 10% лиц, контактирующих с аристолохиевой кислотой [38].
В двух ретроспективных исследованиях показано, что переходно-клеточный рак ВМП, связанный с аристолохиевой кислотой, чаще встречается у женщин [46, 47], хотя прогноз у них более благоприятный, чем у мужчин.
Потребление алкоголя является независимым фактором риска переходно-клеточного рака ВМП. В крупном исследовании типа «случай – контроль» (1569 «случаев» и 506 797 «контролей») показано статистически значимое увеличение риска у пациентов, употреблявших алкоголь, по сравнению с лицами, никогда не употреблявшими алкоголь (отношение шансов 1,23; 95% ДИ 1,08–1,40; p = 0,001). Пороговый показатель для повышения риска составляет 15 г алкоголя в сутки. Кроме того, эффект носит дозозависимый характер [48].
Различия в способности взаимодействия канцерогенов могут объяснять восприимчивость к развитию переходно-клеточного рака. Поскольку определенный генетический полиморфизм может быть связан с увеличением риска развития и прогрессирования болезни, имеет значение вариабельность в индивидуальной восприимчивости к указанным выше факторам риска. Переходноклеточный рак ВМП и РМП могут иметь общие факторы риска развития или общие механизмы повреждения молекулярных путей [21]. К настоящему времени описано два случая полиморфизма, специфичного для рака ВМП [49].
3.3. Гистология и классификация
3.3.1. Гистологические типы
Опухоли ВМП с непереходно-клеточной морфологической структурой встречаются довольно редко [50, 51], но различные морфологические варианты могут наблюдаться почти в 25% случаев [52, 53]. Плоскоклеточный рак мочевыводящих путей чаще встречается при хроническом воспалении и инфекции, связанных с мочекаменной болезнью [54–57]. Плоскоклеточный рак ВМП встречается примерно в 15% случаев опухолей [55]. Они всегда относятся к опухолям высокой степени злокачественности и имеют менее благоприятный прогноз по сравнению с чистым переходно-клеточным раком [53, 58]. Другие, более редкие гистологические варианты включают саркоматоидную карциному и переходно-клеточный рак с инвертированным ростом [59].
Карцинома собирательных трубочек имеет аналогичные с переходно-клеточным раком
ВМП характеристики, но отличается уникальной транскриптомной сигнатурой, относящейся к почечно-клеточному раку, с предполагаемым происхождением из клеток дистальных извитых канальцев [35]. По этой причине она относится к раку почки, а не раку ВМП [60].
3.4. Резюме по данным литературы и рекомендации по эпидемиологии, этиологии и патогенезу
| Резюме по данным литературы | УД |
|---|---|
|
Аристолохиевая кислота и курение повышают риск развития рака ВМП |
2 |
|
У пациентов с синдромом Линча повышен риск развития рака ВМП |
3 |
| Рекомендации | СР |
|---|---|
| Для выявления пациентов с переходно-клеточным раком ВМП необходимо оценивать личный и семейный анамнез на основании Амстердамских критериев | Слабая |
|
Необходимо оценивать влияние курения и воздействие аристолохиевой кислоты |
Слабая |
4. Стадирование и классификация
4.1. Классификация
Классификация и морфология переходно-клеточного рака ВМП сходны с таковыми при РМП [1]. Выделяют неинвазивные папиллярные опухоли (папиллярные переходно-клеточные опухоли с низким злокачественным потенциалом, папиллярный переходно-клеточный рак низкой и высокой степени злокачественности) [61], плоские новообразования (карцинома in situ – CIS) и инвазивный рак. Как и при опухоля мочевого пузыря, непереходно-клеточные варианты являются неблагоприятным фактором риска.
4.2. TNM-классификация
В таблице 1 представлена TNM-классификация [62]. В качестве регионарных лимфатических узлов (ЛУ) рассматриваются ЛУ ворот почки и забрюшинные ЛУ, а для средней или нижней трети мочеточника – тазовые ЛУ. Сторона поражения не влияет на стадию N.
4.3. Степень злокачественности
В 2004 г. ВОЗ и Международное общество урологической патологии (ISUP) опубликовали новую классификацию неинвазивных переходно-клеточных опухолей, в которой представлена другая стратификация пациентов по сравнению с классификацией ВОЗ 1973 г. [63, 64]. При этом в 2016 г. опубликовано обновление системы градации ВОЗ 2004 г., в котором не было значимых изменений [63].
Настоящие рекомендации по-прежнему основаны на классификации 1973 и 2004/2016 гг., поскольку в большинстве публикаций используется классификация 1973 г. [61].
4.4. Направления для дальнейшего развития
В исследованиях, посвященных молекулярной классификации, при оценке экспрессии ДНК, РНК и протеинов выделены генетически различные группы опухолей. Описано четыре молекулярных подтипа с различным злокачественным потенциалом, однако при этом неизвестно, влияют ли молекулярные характеристики на эффективность лечения [65].
Таблица 1. TNM-классификация 2017 г. для переходно-клеточного рака ВМП [62]
T – первичная опухоль
Тх первичная опухоль не может быть оценена
Т0 нет данных за наличие первичной опухоли
Та неинвазивный папиллярный рак
Tis carcinoma in situ
Т1 опухоль вовлекает субэпителиальную соединительную ткань
Т2 опухоль поражает мышечный слой
Т3 (почечная лоханка) опухоль прорастает за пределы мышечной оболочки
в перипельвикальную жировую ткань или почечную паренхиму (мочеточник) опухоль
прорастает за пределы мышечного слоя в периуретральную жировую клетчатку
Т4 опухоль вовлекает соседние органы или прорастает через почку в паранефральную
клетчатку
N – регионарные ЛУ
Nх регионарные ЛУ не могут быть оценены
N0 нет метастазов в регионарных ЛУ
N1 метастаз в одном ЛУ не более 2 см в наибольшем измерении
N2 метастаз в одном ЛУ более 2 см или несколько метастазов в ЛУ
М – отдаленные метастазы
М0 нет отдаленных метастазов
М1 есть отдаленные метастазы
5. Диагностика
5.1. Клинические симптомы
Диагноз переходно-клеточного рака ВМП может быть установлен случайно или при обследовании по поводу симптомов, которые, как правило, ограничены. Самым частым симптомом при переходно-клеточном раке ВМП является макро- или микрогематурия (70–80%) [66, 67]. Боль в боку встречается в 20% случаев [68, 69]. При переходно-клеточном раке ВМП могут появляться системные симптомы (анорексия, потеря массы тела, недомогание, тошнота, лихорадка, ночная потливость или кашель), которые должны служить причиной для более глубокого обследования c целью исключения метастазов; они связаны с неблагоприятным прогнозом [68, 69].
5.2. Методы визуализации
5.2.1. Компьютерная томография с контрастированием
Компьютерная томография (КТ) с контрастированием имеет самую высокую диагностическую точность при раке ВМП из всех доступных методов [70]. Согласно данным метаанализа 13 исследований, включавших 1233 пациента, объединенная чувствительность КТ-урографии в диагностике переходно-клеточного рака ВМП составляет 92% (ДИ 88–98), а объединенная специфичность – 95% [71].
Быстрая съемка тонких срезов позволяет получить изотропное изображение с высоким разрешением, которое можно рассматривать в самых разных плоскостях, что помогает поставить диагноз, не ухудшая разрешающую способность. Плоские опухоли при КТ-урографии практически не выявляются, если только они не вызывают массивную инфильтрацию или утолщение стенок.
Наличие увеличенных ЛУ является сильным прогностическим фактором метастазов [72].
5.2.2. Магнитно-резонансная томография
Магнитно-резонансная (МР) урография показана тем пациентам, которым нельзя выполнить КТ с контрастированием, как правило при противопоказаниях к лучевой нагрузке или введению йодсодержащих контрастных препаратов [73]. Чувствительность МР-урографии для опухолей размером менее 2 см после введения контрастного вещества составляет 75% [73]. Проведение МРТ с введением контрастных веществ, содержащих гадолиний, противопоказано пациентам с тяжелой почечной недостаточностью (клиренс креатинина менее 30 мл/мин), учитывая высокий риск нефрогенного системного фиброза. КТ-урография является более предпочтительным методом в диагностике рака ВМП, чем МР-урография.
5.3. Цистоскопия и цитологическое исследование мочи
Уретроцистоскопия является важнейшей частью диагностики переходно-клеточного рака ВМП для исключения сопутствующего РМП [10, 12]. Положительное цитологическое исследование мочи при нормальных результатах цистоскопии мочевого пузыря и исключении карциномы in situ в мочевом пузыре или простатическом отделе уретры позволяет с высокой степенью вероятности предположить наличие рака ВМП [1, 74, 75]. Цитология менее чувствительна к раку ВМП, чем к РМП, и идеальный вариант подразумевает выполнение ее in situ в лоханке [76]. Ретроградная уретеропиелография остается одним из вариантов диагностики опухоли ВМП [70, 77, 78]. Цитологическое исследование мочи из лоханки и мочеточника желательно выполнять до введения значительного количества контрастного вещества для ретроградной уретеропиелографии, поскольку контрастное вещество может испортить цитологические образцы [78, 79]. Цитологическое исследование с перемешиванием позволяет выявить до 91% злокачественных опухолей, что сопоставимо с гистологическим исследованием биопсийного материала [80].
Чувствительность флуоресцентной гибридизации in situ (FISH) для выявления молекулярных изменений, характерных для рака ВМП, составляет около 50%, и по этой причине данный метод не рекомендуется для рутинной клинической практики [81–83].
5.4. Диагностическая уретероскопия
Для визуализации и биопсии мочеточника и чашечно-лоханочной системы почки используется гибкая уретероскопия. Уретероскопия позволяет оценить наличие, внешний вид и размер опухоли. Биопсия позволяет определить степень злокачественности в 90% случаев с низким уровнем ложноотрицательных результатов вне зависимости от размера образца [84]. Диагностическая биопсия может привести к занижению степени злокачественности, что требует тщательного наблюдения в том случае, если проводится органосохраняющее лечение [85]. Уретероскопия также дает возможность селективно взять материал для цитологического исследования с целью выявления карциномы in situ [78, 86, 87]. Оценка стадии при биопсии, выполненной во время уретероскопии, может быть затруднительной.
Комбинация степени злокачественности по данным биопсии, изменений при инструмен тальной диагностике, например гидронефроза, и цитологического исследования мочи помогает сделать выбор между РНУ и эндоскопическим лечением [87, 88]. Хотя результаты двух исследований свидетельствуют о повышении риска внутрипузырного рецидива у пациентов, которым перед РНУ проводилась уретероскопия [88, 89], в другой публикации получены противоположные результаты [91].
Техническое развитие гибких уретероскопов и использование новейших технологий визуализации улучшают качество изображения и диагностику плоских образований [89]. Наиболее перспективной технологией является узкополосная визуализация (NBI), но к настоящему времени получены только предварительные результаты [88, 93, 94]. Оптическая когерентная томография и конфокальная лазерная эндомикроскопия (Cellvizio©) используются in vivo для оценки степени злокачественности и/или стадии опухоли и/или для стадирования и имеют хорошую корреляцию с послеоперационным заключением при раке высокой степени злокачественности [95, 96]. В разделе 5.6 приводятся рекомендации по диагностике.
5.5. Отдаленные метастазы
Перед радикальным лечением важно исключать наличие отдаленных метастазов. КТ и МРТ являются методами выбора для выявления поражения легких и органов брюшной полости [71].
5.6. Резюме по данным литературы и рекомендации по диагностике переходно-клеточного рака верхних мочевыводящих путей
| Резюме по данным литературы | УД |
|---|---|
|
Диагностика переходно-клеточного рака ВМП основана на КТ-урографии и уретероскопии. |
2 |
|
Селективное цитологическое исследование мочи имеет высокую чувствительность в выявлении опухолей высокого риска, включая карциному in situ |
3 |
|
Уретроцистоскопия позволяет выявить сопутствующий РМП |
2 |
| Рекомендации | СР |
|---|---|
|
Для исключения сопутствующего рака мочевого пузыря необходимо выполнить уретроцистоскопию |
Сильная |
|
В рамках диагностического поиска и стадирования рекомендуется выполнить КТ-урографию |
Сильная |
|
Диагностическая уретероскопия с биопсией показана в случае неубедительного результата методов визуализации и цитологического исследования мочи и/или при необходимости стратификации риска опухоли |
Сильная |
|
При наличии противопоказаний к КТ показана МР-урография |
Сильная |
6. Прогноз
6.1. Прогностические факторы
При прорастании мышечной стенки переходно-клеточный рак ВМП, как правило, имеет неблагоприятный прогноз. Показатели пятилетней канцероспецифической выживаемости у пациентов с опухолями стадии pT2/pT3 составляют < 50% по сравнению с < 10% при стадии pT4 [97–100].
Ниже описаны основные прогностические факторы; на рис. 6.1 представлен обширный список факторов.
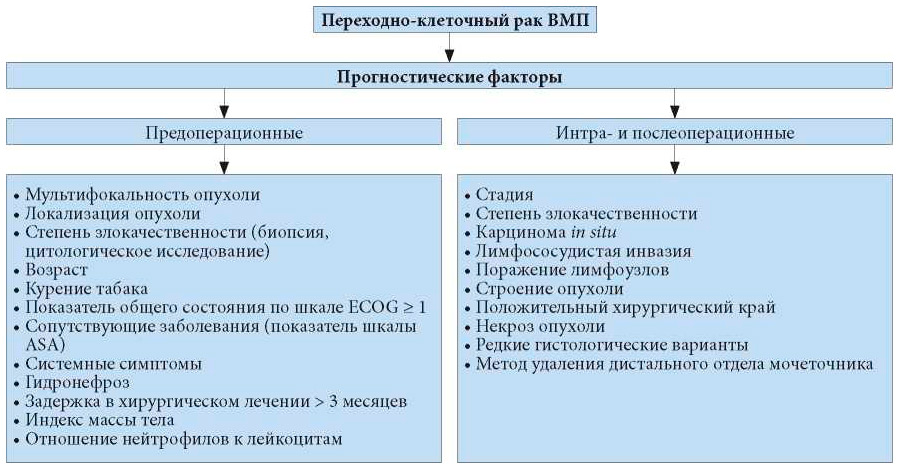
Рис. 6.1. Переходно-клеточный рак верхних мочевыводящих путей – прогностические факторы
6.2. Предоперационные факторы
6.2.1. Возраст и пол
Возраст пациента на момент выполнения РНУ независимо связан со снижением канцероспецифической выживаемости [98, 101, 102] (УД: 3). Значительную часть пожилых пациентов можно излечить с помощью РНУ [103], вследствие чего возраст сам по себе не должен быть причиной отказа от радикального лечения [102, 103]. Пол больше не считается независимым прогностическим фактором, влияющим на смертность от рака ВМП [20, 98, 104].
6.2.2. Этническое происхождение
В одном многоцентровом исследовании не выявлено межрасовых различий [105], но в популяционных исследованиях показано, что у пациентов афроамериканской расы результаты лечения хуже, чем у лиц другого этнического происхождения (УД: 3). В другом исследовании показаны различия между пациентами в Китае и США при диагностике рака (факторы риска, характеристики заболевания и прогностические факторы неблагоприятных исходов) [13].
6.2.3. Курение табака
Курение на момент постановки диагноза повышает риск рецидива и смертности после РНУ [106, 107], а также повышает риск внутрипузырного рецидива [108] (УД: 3). Описана тесная взаимосвязь между курением табака и прогнозом; отказ от курения благоприятно влияет на онкологические показатели.
6.2.4. Локализация, мультифокальность, размер опухоли и гидронефроз
Первичная локализация опухоли является прогностическим фактором [109, 110] (УД: 3). После поправки на стадию опухоли при многоочаговых опухолях и опухолях мочеточника прогноз хуже, чем при опухолях лоханки [98, 109–114]. Гидронефроз связан с распространенным процессом и неблагоприятными онкологическими результатами [68, 72, 79].
6.2.5. Задержка хирургического лечения
Задержка между диагностикой инвазивной опухоли и ее удалением может повышать риск прогрессирования. Временная граница от выбора РНУ до ее выполнения не должна превышать 12 недель [115–119] (УД: 3).
6.2.5. Задержка хирургического лечения
Задержка между диагностикой инвазивной опухоли и ее удалением может повышать риск прогрес сирования. Временная граница от выбора РНУ до ее выполнения не должна превышать 12 недель [115–119] (УД: 3).
6.2.6. Другие факторы
Показатель шкалы Американского общества анестезиологов (ASA) статистически значимо коррелирует с канцероспецифической выживаемостью после РНУ [120] (УД: 3), так же как и показатель шкалы ECOG [121]. Ожирение и повышенный индекс массы тела отрицательно влияют на канцероспецифическую выживаемость [122] (УД: 3). Высокое отношение нейтрофилов к лимфоцитам до лечения [123, 124] и низкий уровень альбумина [125] также коррелируют с более высокой канцероспецифической смертностью.
6.3. Послеоперационные факторы
6.3.1. Стадия и степень злокачественности опухоли
Основными прогностическими факторами являются стадия и степень злокачественности опухоли [18, 87, 98, 126, 127].
6.3.2. Поражение лимфоузлов
Поражение ЛУ и экстранодальное прорастание являются сильными прогностическими факторами результатов лечения рака ВМП [128, 129]. Лимфодиссекция во время РНУ позволяет лучше стадировать процесс [100, 129–131] (УД: 3), но ее лечебная роль остается противоречивой.
6.3.3. Лимфососудистая инвазия
Лимфососудистая инвазия определяется примерно в 20% случаев рака ВМП и является независимым прогностическим фактором выживаемости [132–134]. Статус лимфососудистой инвазии следует систематически включать в протокол патоморфологического исследования после РНУ [132, 135, 136] (УД: 3).
6.3.4. Хирургический край
Положительный хирургический край в мягких тканях после РНУ является важным фактором развития метастазов. Патоморфологи должны искать и описывать положительный край на уровне удаления мочеточника, краев стенки мочевого пузыря и вокруг края опухоли [137] (УД: 3).
6.3.5. Патоморфологические факторы
Обширный некроз опухоли (> 10%) является независимым прогностическим фактором у пациентов, которым проводят РНУ [138, 139] (УД: 3). Кроме того, строение опухоли также является сильным прогностическим фактором, поскольку наличие опухоли на широком основании связанос неблагоприятным прогнозом [140, 141] (УД: 3). Наличие сопутствующей карциномы in situ при локализованном переходно-клеточном раке ВМП связано с повышением риска рецидива и канцероспецифической смертности [142, 143] (УД: 3). Макроскопическая инфильтрация или инвазия окололоханочной жировой клетчатки связана с более высоким риском рецидива после РНУ по сравнению с микроскопической инфильтрацией паренхимы почки [52, 144].
6.4. Молекулярные маркеры
В ряде исследований оценивали прогностическое влияние различных тканевых маркеров, связанных с клеточной адгезией (Е-кадерин [145] и CD24), микросателлитной нестабильностью [146], клеточной дифференциацией [147, 148], ангиогенезом, клеточной пролиферацией (Ki67), эпителиально-мезенхимальным переходом, митозом, апоптозом, сосудистой инвазией, экспрессией рецептора программируемой клеточной смерти (лиганда) 1 (PD-1/PDL-1) [149] и белком c-MET [98, 150].
Однако в связи с редкостью заболевания основными ограничениями вышеприведенных исследований являются их ретроспективный характер и небольшой размер выборки. В настоящее время ни один из маркеров не соответствует критериям, необходимым для использования в клинической практике с целью определения тактики лечения.
6.5. Прогностические инструменты
В настоящее время предложены три модели для предоперационного прогнозирования мышечноинвазивного/нелокализованного рака [151–153].
Кроме того, описано пять прогностических номограмм на основании стандартных морфологических характеристик [100, 154–158].
6.5.1. Внутрипузырный рецидив
В метаанализе выявлены статистически значимые прогностические факторы внутрипузырного рецидива после РНУ [159] (УД: 3). Описаны три категории факторов повышенного риска рецидива:
- характеристики пациента (мужской пол, РМП в анамнезе, курение, хроническая болезнь почек до операции);
- характеристики опухоли (положительный результат цитологического исследования, локализация опухоли в мочеточнике, мультифокальность, инвазивная стадия, некроз);
- факторы лечения, включая технику (лапароскопический доступ, экстравезикальное иссечение устья) и положительный хирургический край [159].
Кроме того, диагностическая уретероскопия повышает риск внутрипузырного рецидива после РНУ [89, 90] (УД: 3). На основании публикаций с низким уровнем доказательности можно сделать вывод, что однократная инстилляция после диагностической/лечебной уретероскопии при неметастатическом переходно-клеточном раке ВМП позволяет снизить риск внутрипузырного рецидива, аналогично ее выполнению после РНУ [119–121].
6.6. Стратификация риска неметастатического рака верхних мочевыводящих путей
Поскольку при переходно-клеточном раке ВМП трудно клинически оценить стадию опухоли, следует стратифицировать опухоли в группу низкого и высокого риска, чтобы отобрать пациентов, которым можно проводить органосохраняющее лечение [160, 161] (рис. 6.2).
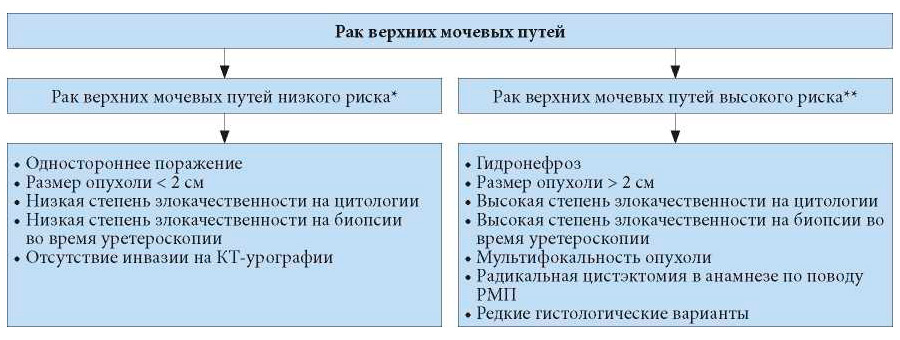
* Должны присутствовать все факторы.
** Может присутствовать один из этих факторов.
Рис. 6.2. Стратификация риска рака верхних мочевыводящих путей перед вмешательством
6.7. Резюме по данным литературы и рекомендации по прогнозу
| Резюме по данным литературы | УД |
|---|---|
|
Возраст не является исключающим фактором для выполнения РНУ, если операция показана в качестве радикального метода лечения |
3 |
|
Основные послеоперационные прогностические факторы включают гидронефроз, мультифокальность, размер, стадию и степень злокачественности опухоли, метастазы в лимфоузлы, лимфососудистую инвазию и редкие гистологические варианты |
3 |
| Рекомендации | СР |
|---|---|
|
Необходимо использовать предоперационные факторы для стратификации риска и определения тактики лечения |
Слабая |
7. Лечение
7.1. Локализованный рак
7.1.1. Органосохраняющее лечение
Органосохраняющее лечение рака ВМП позволяет избавить пациента от риска осложнений, связанных с РНУ, и при этом не ухудшить онкологические результаты и сохранить функцию почки, как показано в метаанализе, проведенном рабочей группой по НИРМП [162]. При раке низкого риска оно является предпочтительным подходом, при котором показатели выживаемости сопоставимы с РНУ [162]. Его необходимо предлагать во всех случаях низкого риска вне зависимости от состояния контралатеральной почки. При опухолях высокой степени злокачественности органосохра няющее лечение показано в отдельных случаях (при почечной недостаточности или единственной функционирующей почке) (УД: 3).
Рекомендации по органосохраняющему лечению переходно-клеточного рака ВМП представлены в разделе 7.1.1.5.
7.1.1.1. Уретероскопия
При раке низкого риска можно проводить эндоскопическое лечение [163, 164]. Для удаления опухолей чашечно-лоханочной системы требуется гибкий уретероскоп [165]. Пациента необходимо информировать о выполнении ранней (повторной) уретероскопии [166] и более тщательного и строгого наблюдения. В таких случаях требуется полная резекция или деструкция опухоли [166]. Тем не менее сохраняется риск прогрессирования рака после эндоскопического лечения из-за низкой точности методов визуализации и биопсии для стратификации риска и определения биологического поведения опухоли [167].
7.1.1.2. Чрескожный доступ
Чрескожное лечение можно рассматривать при опухолях лоханки почки низкого риска [164, 168] (УД: 3). Оно показано при локализации рака низкого риска в нижней чашке, к которой невозможно или трудно добраться гибким уретерореноскопом. Однако данный подход стали использовать реже в связи с улучшением материалов и модернизацией эндоскопов с отклонением дистального конца [164, 168]. Чрескожный доступ сопровождается риском имплантационных метастазов.
7.1.1.3. Сегментарная резекция мочеточника
Сегментарная резекция мочеточника с широким иссечением краев позволяет получить материал для определения стадии и степени злокачественности и сохранить ипсилатеральную почку. Во время сегментарной резекции можно выполнить лимфодиссекцию [162]. Сегментарная резекция проксимальных двух третей мочеточника связана с более высокой частотой рецидива, чем резекция дистальной трети [169, 170] (УД: 3).
Полная резекция дистального отдела мочеточника с неоцистостомой показана при опухолях дистального отдела мочеточника низкого риска, если они не могут быть удалены полностью эндоскопически, и при опухолях высокого риска, когда органосохраняющее лечение необходимо для сохранения функции почки [99, 169, 170] (УД: 3). Полное удаление мочеточника с замещением сегментом подвздошной кишки технически выполнимо, но показано лишь в тех случаях, когда обязательно необходимо органосохраняющее лечение у пациентов с раком низкого риска [171].
Открытая резекция лоханки или резекция почки практически не имеет показаний. Открытая резекция опухолей чашечно-лоханочной системы практически не выполняется.
7.1.1.4. Адъювантная местная терапия
В исследованиях изучалось антеградное введение вакцины БЦЖ (бациллы Кальметта–Герена) или митомицина C через нефростому при карциноме in situ (после полного удаления опухоли) [143, 172] (УД: 3). Кроме того, можно использовать ретроградное введение по мочеточниковому катетеру, но антеградный и ретроградный доступы несут определенный риск вследствие возможной обструкции мочеточника с развитием пиеловенозного рефлюкса во время инстилляции/перфузии. Хотя можно использовать рефлюкс препарата по стенту с двойным J-концом, это не рекомендуется, поскольку он часто не достигает почечной лоханки [173–176]. Недавно опубликованы систематический обзор и метаанализ, в которых оценивали онкологические результаты у пациентов с папиллярным переходно-клеточным раком ВМП или карциномой in situ ВМП. Пациентам проводились органосохраняющее лечение и адъювантная внутриполостная терапия. Авторы оценивали влияние адъювантной терапии (химиотерапевтические препараты и/или иммунотерапия с БЦЖ-терапией) после органосохраняющего лечения папиллярного переходно-клеточного рака ВМП (Ta-T1) и адъювантной БЦЖ-терапии при карциноме in situ. Результаты свидетельствуют о сопоставимой эффективности различных методов введения (антеградный, ретроградный, комбинированный) в отношении частоты рецидива, прогрессирования, канцероспецифической и общей выживаемости.
Следует отметить, что частота рецидива после адъювантной инстилляции сравнима с литературными данными для пациентов, не получавших адъювантного лечения, что ставит под сомнение его эффективность [177]. В анализ были включены ретроспективные исследования с небольшим числом пациентов, предвзятостью публикаций и неточностями в описании результатов.
7.1.1.5. Рекомендации по органосохраняющему лечению переходно-клеточного рака верхних мочевыводящих путей
| Рекомендации | СР |
|---|---|
|
Органосохраняющее лечение является предпочтительным вариантом для пациентов с опухолями низкого риска |
Сильная |
|
Органосохраняющее лечение опухолей высокого риска возможно только при локализации в дистальном отделе мочеточника |
Слабая |
|
Пациентам с единственной почкой и/или нарушением функции почек показано органосохраняющее лечение, если оно не нарушает онкологические результаты. Выбор тактики лечения проводится на индивидуальной основе, с активным участием пациента |
Сильная |
7.1.2. Радикальная нефруретерэктомия
7.1.2.1. Хирургический доступ
7.1.2.1.1. Открытая радикальная нефруретерэктомия
РНУ с резекцией устья представляет собой стандарт лечения при раке высокой степени злокачественности, вне зависимости от локализации опухоли [18] (УД: 3). РНУ должна соответствовать принципам онкологии, которые включают антибластику посредством недопущения входа в мочевыводящие пути во время резекции опухоли [18]. В разделе 7.1.6 представлены рекомендации по РНУ.
7.1.2.1.2. Лапароскопическая радикальная нефруретерэктомия
В литературе описаны случаи диссеминации в забрюшинном пространстве и по ходу расположения троакаров при удалении опухолей больших размеров в условиях пневмоперитонеума [178, 179].
Необходимо соблюдать несколько правил, чтобы избежать диссеминации опухоли при лапароскопической операции:
- избегать нарушения целостности мочевыводящих путей;
- избегать прямого контакта инструментов с опухолью;
- лапароскопическая РНУ должна проходить в закрытой системе. Нельзя морцеллировать опухоль, а для извлечения препарата необходимо использовать контейнер;
- почку и мочеточник нужно удалять единым блоком с резецированной стенкой мочевого пузыря в области устья;
- наличие большой инвазивной опухоли (Т3/Т4 и/или N+/М+) является противопоказанием к лапароскопической РНУ, поскольку она уступает по эффективности открытой РНУ [180, 181].
Лапароскопическая РНУ безопасна в опытных руках при соблюдении строгих принципов онкологии. Наблюдается тенденция к получению сопоставимых результатов после лапароскопической и открытой РНУ [179, 182–185] (УД: 3). Только в одном проспективном рандомизированном исследовании показано, что лапароскопическая РНУ не уступает открытой при неинвазивном переходно-клеточном раке ВМП [181] (УД: 2). За последние 30 лет онкологические результаты после РНУ значительно не изменились, несмотря на улучшение стадирования и хирургической техники [186] (УД: 3). Кроме того, можно использовать робот-ассистированный доступ. В недавно опубликованных исследованиях показаны сопоставимые онкологические результаты [187–189].
7.1.2.1.3. Удаление стенки мочевого пузыря
Резекция дистального отдела мочеточника и его устья необходима в связи с риском развития рецидива в этой зоне [159, 169, 190–192]. Описано несколько техник для упрощения резекции дистального отдела мочеточника, включая отрыв, экстирпацию, трансуретральную резекцию интрамурального отдела мочеточника и инвагинацию. Ни одна из этих методик не сопоставима по эффективности с полной резекцией устья мочеточника со стенкой мочевого пузыря [15, 190, 191] (УД: 3).
7.1.2.1.4. Лимфодиссекция
Использование шаблона для лимфодиссекции, вероятнее всего, в большей степени влияет на выживаемость, чем количество удаленных ЛУ [193]. Соблюдение шаблона и полноты лимфодиссекции позволяет улучшить канцероспецифическую выживаемость у пациентов с инвазивным раком и снизить риск местного рецидива [194]. Даже при отсутствии клинических [195] или морфологических признаков поражения ЛУ [196] лимфодиссекция способствует улучшению выживаемости.
Риск метастазов в ЛУ увеличивается вместе со стадией опухоли [130]. Лимфодиссекция не является необходимой при опухолях Та-Т1 вследствие низкого риска метастазов в ЛУ [197–200], однако, учитывая возможные неточности в предоперационном стадировании, лимфодиссекцию необходимо выполнять всем пациентам в соответствии с анатомическим шаблоном. В литературе описаны шаблоны для лимфодиссекции [194, 201, 202].
7.1.3. Периоперационная химиотерапия в качестве дополнения к радикальной нефруретерэктомии
7.1.3.1. Неоадъювантная химиотерапия
В ряде ретроспективных исследований, в которых оценивали роль неоадъювантной химиотерапии, получены перспективные результаты по снижению стадии и частоте полного ответа [203–207]. Не-
оадъювантная терапия позволяет снизить риск рецидива и смертность по сравнению с РНУ в режиме монотерапии [208–210]. К настоящему времени не опубликовано результатов рандомизированных исследований.
7.1.3.2. Адъювантная химиотерапия
В ретроспективных исследованиях получены противоречивые результаты по эффективности адъювантной химиотерапии [211–213]. В популяционном исследовании (n = 3253) показано увеличение общей выживаемости при переходно-клеточном раке стадии pT3/T4 и/или pN+ [214], хотя эти результаты не подтверждены в многоцентровом когортном исследовании у пациентов с РМП стадии pT2-T4 и/или N+ (n = 1544) [212].
Основным ограничением адъювантной химиотерапии при распространенном раке остается невозможность использовать полную дозу цисплатина после РНУ вследствие нарушения почечной функции [215, 216]. На конгрессах были представлены многообещающие результаты проспективного рандомизированного исследования II фазы, в котором оценивали преимущество адъювантной химиотерапии на основе препаратов платины при переходно-клеточном раке ВМП стадии pT2-4, N0-3M0. Ожидается публикация результатов данного исследования.
7.1.4. Адъювантная лучевая терапия после радикальной нефруретерэктомии
Адъювантная лучевая терапия снижает риск местного рецидива после РНУ. Данные литературы остаются противоречивыми и не позволяют сделать окончательные выводы [217–220]. Более того, необходимо оценить дополнительную пользу лучевой терапии при проведении химиотерапии [219].
7.1.5. Адъювантная внутрипузырная химиотерапия
Частота внутрипузырного рецидива после РНУ составляет 22–47% [116, 191]. В двух проспективных рандомизированных исследованиях [221, 222] и метаанализе [223] показано, что однократная внутрипузырная химиотерапия непосредственно после операции (митомицин C, пирарубицин, в течение 2–10 дней) снижает риск внутрипузырного рецидива в течение года (УД: 2). При подозрении на наличие экстравазации перед инстилляцией необходимо выполнить цистографию.
Несмотря на отсутствие прямого подтверждения эффективности внутрипузырной инстилляции химиопрепаратов после органосохраняющего лечения, однократное введение представляется эффективным (УД: 4). На рис. 7.1 и 7.2 представлен алгоритм лечения.
7.1.6. Резюме по данным литературы и рекомендации по лечению неметастатического рака верхних мочевыводящих путей высокого риска
| Резюме по данным литературы | УД |
|---|---|
|
Неполное удаление стенки мочевого пузыря в области устья мочеточника повышает риск внутрипузырного рецидива |
3 |
|
Лимфодиссекция повышает выживаемость при инвазивном переходно-клеточном раке ВМП |
3 |
|
Периоперационная химиотерапия повышает выживаемость |
3 |
|
Однократная внутрипузырная химиотерапия в послеоперационном периоде снижает риск внутрипузырного рецидива |
1 |
| Рекомендации | СР |
|---|---|
|
РНУ показана при неметастатическом переходно-клеточном раке ВМП высокого риска |
Сильная |
|
При нелокализованном переходно-клеточном раке ВМП показана открытая РНУ |
Слабая |
|
Необходимо полностью резецировать стенку мочевого пузыря в области устья мочеточника |
Сильная |
|
При переходно-клеточном раке ВМП высокого риска показана лимфодиссекция по анатомическим шаблонам |
Сильная |
|
При инвазивном переходно-клеточном раке ВМП показана периоперационная химиотерапия |
Слабая |
|
Послеоперационная внутрипузырная химиотерапия снижает риск внутрипузырного рецидива |
Сильная |
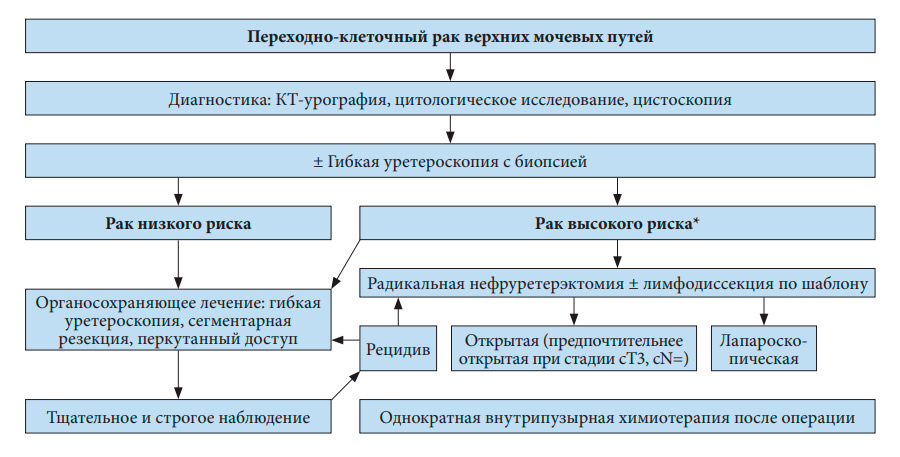
* У пациентов с единственной почкой можно рассмотреть более консервативный подход.
Рис. 7.1. Предлагаемый алгоритм лечения локализованного переходно-клеточного рака верхних мочевыводящих путей
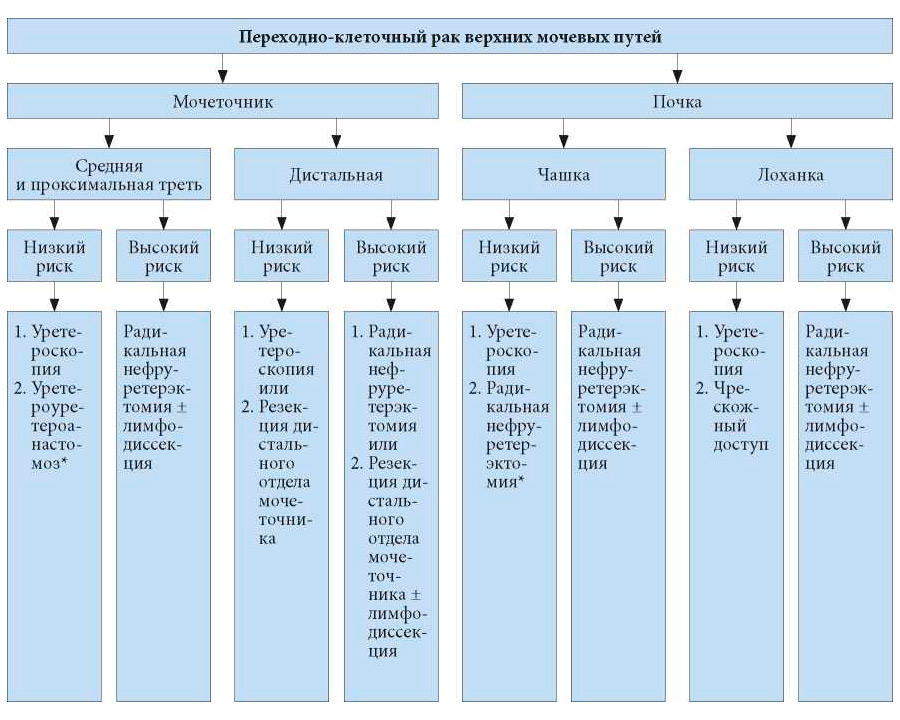
1. Первый вариант лечения
2. Второй вариант лечения
* В случае невозможности эндоскопического лечения.>
Рис. 7.2. Хирургическое лечение в зависимости от локализации и акторов риска
7.2. Метастатическая болезнь
7.2.1. Радикальная нефруретерэктомия
В ряде обсервационных исследований оценивали роль РНУ в лечении метастатического переходно-клеточного рака ВМП [224–227]. Несмотря на ограниченность данных, РНУ повышает канцероспецифическую [224, 226, 227] и общую выживаемость у отдельных пациентов, особенно при отсутствии противопоказаний к химиотерапии на основе цисплатина [225, 226]. Следует отметить, что эти преимущества могут относиться только к пациентам с одной локализацией метастазов [226]. Учитывая высокий риск неточностей в обсервационных исследованиях,
в которых оценивали РНУ при метастатическом раке, показания к хирургическому лечению должны быть только паллиативными, с целью контроля над симптомами [17, 106] (УД: 3). При частичном или полном ответе на индукционную химиотерапию можно обсудить с пациентом выполнение РНУ.
7.2.2. Метастазэктомия
В литературе отсутствуют данные по целесообразности метастазэктомии у пациентов с распространенным процессом. Результаты исследования, включавшего пациентов с раком ВМП и мочевого пузыря, свидетельствуют о безопасности и онкологической эффективности данного подхода у тщательно отобранных пациентов с ожидаемой продолжительностью жизни более 6 месяцев [228–230]. Это подтверждено в самом крупном и наиболее свежем исследовании, опубликованном на данный момент [231]. При отсутствии рандомизированных исследований следует определять тактику на индивидуальной основе и принимать решение об удалении метастазов (хирургическим путем или с использованием других методов) совместно с пациентом.
7.2.3. Системная химиотерапия
7.2.3.1. Первая линия терапии
Экстраполируя данные по РМП и результаты небольших, одноцентровых исследований по раку ВМП, комбинированная химиотерапия на основе препаратов платины (особенно цисплати-на) представляется эффективной в рамках первой линии терапии метастатического рака ВМП. В ретроспективном анализе трех рандомизированных исследований показано, что локализация первичной опухоли не оказывает влияния на выживаемость без прогрессирования или общую выживаемость у пациентов с местнораспространенным или метастатическим переходно-клеточ-
ным раком ВМП, которым проводится комбинированная химиотерапия на основе препаратов платины [232].
В литературе представлены результаты единичных исследований, в которых оценивали роль иммунотерапии в рамках первой линии терапии у пациентов с переходно-клеточным раком ВМП без противопоказаний к цисплатину. Прежде всего в исследовании II фазы без группы сравнения, включавшем 370 пациентов, показано, что у больных с переходно-клеточным раком ВМП (n = 69/19%) показатель объективного ответа составил 22% [233]. В общей когорте экспрессия PD-L1 10% была связана с более высокой частотой ответа на пембролизумаб, кото-
рый имел относительно приемлемую токсичность. Далее, в исследовании II фазы атезолизумаба без группы сравнения, включавшем 119 пациентов, получавших атезолизумаб, показано, что у больных с переходно-клеточным раком ВМП с противопоказаниями к цисплатину (n = 33, 27,7%) показатель объективного ответа составил 39% [234]. Медиана общей выживаемости во всей когорте составила 15,9 месяца, а токсичность была относительно приемлемой. К настоящему времени не опубликовано других данных по первой линии терапии, но в ряде исследо-
ваний III фазы оценивают пембролизумаб (NCT02853305 [235]), атезолизумаб (NCT028076[236]) и дурвалумаб (NCT02516241 [237]) в режиме монотерапии и комбинированную иммунотерапию ниволумабом (NCT03036098 [238]), дурвалумабом (NCT02516241 [237]) или пембролизумабом (NCT02178722 [239]) у пациентов с метастатическим переходно-клеточным раком, включая рак ВМП.
7.2.3.2. Вторая линия терапии
Аналогично РМП выбор терапии второй линии метастатического переходно-клеточного рака ВМП остается затруднительным. В дополнительном анализе подгруппы больных метастатическим/местнораспространенным переходно-клеточным раком ВМП показано, что винфлунин обладает сопоставимой эффективностью, как и у пациентов с прогрессированием метастатического РМП после химиотерапии на основе цисплатина [240].
Более важно, что в рандомизированном исследовании III фазы, включавшем 542 пациента с распространенным переходно-клеточным раком, ранее получавших химиотерапию на основе препаратов платины, показано, что пембролизумаб снижает риск летального исхода у пациентов с переходно-клеточным раком ВМП почти на 50% (n = 75, 13,8%), хотя различие имело пограничное значение [241]. В общей когорте частота объективного ответа составила 21,1%, а медиана общей выживаемости – 10,3 месяца. Примечательно, что, хотя не проводилось анализа подгрупп для пациентов с переходно-клеточным раком ВМП (n = 65/21%), в исследовании II фазы без группы сравнения показана длительная активность атезолизумаба, связанная с экспрессией PD-L1 на иммунных клетках у больных метастатическим переходно-клеточным раком [242]. У пациентов с гиперэкспрессией PD-L1 частота объективного ответа составила 26% по сравнению с 15% во всей популяции. Однако в рандомизированном исследовании III фазы не показано увеличения общей выживаемости по сравнению с химиотерапией у пациентов с гиперэкспрессией PD-L1, включая 51 больного переходно-клеточным раком ВМП (21,8%), несмотря на более приемлемый профиль безопасности [243].Частота объективного ответа у других препаратов для иммунотерапии, включая ниволумаб [244], авелумаб [245, 246] и дурвалумаб [247], в общей когорте больных метастатическим переходно-клеточным раком, резистентным к препаратам платины, варьирует от 17,8% [247] до 19,6% [244], а медиана общей выживаемости – от 7,7 до 18,2 месяца. Эти результаты получены только в исследованиях I или II фазы без группы сравнения, и число пациентов с раком ВМП было указано только в исследовании авелумаба (n = 7/15,9%) [246] без анализа подгрупп в зависимости от первичной локализации опухоли.
Комбинированная иммунотерапия ниволумабом и ипилимумабом имеет выраженную противоопухолевую активность. В многоцентровом исследовании I/II фазы, включавшем 78 пациентов с метастатическим раком ВМП и прогрессированием после химиотерапии на основе препаратов платины, частота объективного ответа составила 38% [248]. Хотя в это исследование вошли пациенты с переходно-клеточным раком ВМП, авторы не провели анализ подгрупп. Другие комбинации иммунотерапии могут быть эффективными в рамках второй линии терапии, но к настоящему времени не получено убедительных данных [249].
7.2.4. Резюме по данным литературы и рекомендации по лечению метастатического переходно-клеточного рака ВМП
| Резюме по данным литературы | УД |
|---|---|
|
РНУ у отдельных пациентов с метастатическим раком позволяет улучшить качество жизни и онкологические результаты |
3 |
|
Комбинированная химиотерапия на основе цисплатина позволяет повысить медиану выживаемости |
2 |
|
Монохимиотерапия и комбинированная химиотерапия на основе карбоплатина уступают по эффективности комбинированной химиотерапии на основе цисплатина в отношении частоты полного ответа и выживаемости |
3 |
|
Комбинированную химиотерапию без препаратов платины не сравнивали со стандартной химиотерапией у пациентов с или без противопоказаний к комбинированной химиотерапии на основе цисплатина |
4 |
|
По результатам исследования III фазы, ингибитор PD-1 пембролизумаб одобрен к применению у пациентов с прогрессированием рака во время или после комбинированной химиотерапии на основе препаратов платины |
1b |
|
По результатам исследования II фазы, ингибитор PD-L1 атезолизумаб одобрен к применению у пациентов с прогрессированием рака во время или после комбинированной химиотерапии на основе препаратов платины |
2a |
|
По результатам исследования II фазы, ингибитор PD-1 ниволумаб одобрен к применению у пациентов с прогрессированием рака во время или после комбинированной химиотерапии на основе препаратов платины |
2a |
|
По результатам исследования III фазы, ингибитор PD-1 пембролизумаб одобрен к применению у пациентов с распространенным или метастатическим переходно-клеточным раком с противопоказаниями к первой линии комбинированной химиотерапии на основе препаратов платины, однако его можно использовать только при наличии экспрессии PD-L1 |
2a |
|
По результатам исследования III фазы, ингибитор PD-L1 атезолизумаб одобрен к применению у пациентов с распространенным или метастатическим переходно-клеточным раком с противопоказаниями к первой линии комбинированной химиотерапии на основе препаратов платины, однако его можно использовать только при наличии экспрессии PD-L1 |
2a |
| Рекомендации | СРh |
|---|---|
|
РНУ показана в качестве паллиативного лечения пациентам с симптоматическим операбельным местнораспространенным раком ВМП |
Слабая |
|
Препараты первой линии для пациентов без противопоказаний к цисплатину |
|
|
Химиотерапия на основе препаратов платины включает схемы GC, MVAC, предпочтительно с Г-КСФ, высокодозный режим MVAC с Г-КСФ или PCG |
Сильная |
|
Карбоплатин и комбинированная химиотерапия без препаратов платины не показаны |
Сильная |
|
Препараты первой линии для пациентов с противопоказаниями к цисплатину |
|
|
Ингибиторы иммунных контрольных точек (пембролизумаб или атезолизумаб) необходимо назначать в зависимости от экспрессии PD-L1 |
Слабая |
|
При отсутствии экспрессии PD-L1 показана комбинированная химиотерапия на основе карбоплатина |
Сильная |
|
Препараты второй линии |
|
|
Ингибитор иммунных контрольных точек (пембролизумаб) показан пациентам с прогрессированием метастатического рака во время или после комбинированной химиотерапии на основе препаратов платины |
Сильная |
|
Ингибитор иммунных контрольных точек (атезолизумаб) показан пациентам с прогрессированием метастатического рака во время или после комбинированной химиотерапии на основе препаратов платины |
Сильная |
|
Винфлунин показан только пациентам с метастатическим раком в качестве препарата второй линии, если нельзя провести иммунотерапию или комбинированную химиотерапию. Кроме того, винфлунин можно использовать в рамках третьей или последующих линий терапии |
Сильная |
8. Наблюдение
Риск рецидива рака ВМП и смерти изменяется по мере наблюдения после операции и, вероятно, со временем становится ниже [250]. Для выявления метахронного РМП (вероятность со временем повышается [251]), местного рецидива и отдаленных метастазов требуется самое строгое наблюдение (раздел 8.1). В разделе 8.1 представлены резюме по данным литературы и рекомендации по наблюдению пациентов.
Режим наблюдения включает цистоскопию и цитологическое исследование мочи в течение > 5 лет [12, 14, 15, 161]. Развитие рецидива в мочевом пузыре не следует рассматривать как появление от даленных метастазов. В случае выполнения органосохраняющего лечения требуется тщательный мониторинг состояния ипсилатеральных ВМП ввиду высокого риска развития рецидива [165, 252, 253]. Несмотря на постоянное совершенствование эндоурологической техники, наблюдение за пациентами, пролеченными консервативно, остается сложной задачей и требует повторного выполнения малоинвазивных манипуляций. Как и при РМП, после органосохраняющего лечения можно проводить повторный «second-look» осмотр, но это не является рутинной практикой [2, 166].
8.1. Резюме по данным литературы и рекомендации по наблюдению переходно-клеточного рака верхних мочевыводящих путей
| Резюме по данным литературы | УД |
|---|---|
|
После органосохраняющего лечения требуется более частое и строгое наблюдение, чем после РНУ |
3 |
| Рекомендации | СР |
|---|---|
|
После РНУ: |
|
|
Опухоли низкого риска |
|
|
Цистоскопия через 3 месяца, далее через 9 месяцев, далее ежегодно в течение 5 лет. |
Слабая |
|
Опухоли высокого риска |
|
|
Цистоскопия и цитологическое исследование мочи через 3 месяца. При отрицательном результате необходимо повторять цистоскопию и цитологическое исследование мочи каждые 3 месяца в течение 2 лет, затем каждые 6 месяцев в течение 5 лет, далее ежегодно |
Слабая |
|
КТ-урографию и КТ органов грудной клетки необходимо проводить каждые 6 месяцев в течение 2 лет, далее ежегодно |
Слабая |
|
После органосохраняющего лечения: |
|
|
Опухоли низкого риска |
|
|
Цистоскопия и КТ-урография через 3 и 6 месяцев, далее ежегодно в течение 5 лет. |
Слабая |
|
Уретероскопия через 3 месяца |
Слабая |
|
Опухоли высокого риска |
|
|
Цистоскопия, цитологическое исследование мочи, КТ-урография и КТ органов грудной клетки через 3 и 6 месяцев, далее ежегодно. |
Слабая |
|
Уретероскопия и цитологическое исследование in situ через 3 и 6 месяцев. |
Слабая |
9. Литература (представлена в конце издания)
10. Конфликт интересов
Все члены группы по составлению клинических рекомендаций по опухолям ВМП предоставили открытый отчет по всем взаимоотношениям, которые они имеют и которые могут быть восприняты как причина конфликта интересов. Эта информация доступна на сайте Европейской ассоциации урологов: http://uroweb.org/guideline/upper-urinary-tract-urothelial-cell-carcinoma/. Данные рекомендации были созданы при финансовой поддержке ЕАУ. При этом не использовались внешние источники финансирования и поддержки. ЕАУ – некоммерческая организация, финансовые издержки которой ограничиваются административными расходами, а также оплатой поездок и встреч. Авторам рекомендаций ЕАУ не предоставляла гонораров или какой-либо другой компенсации.
11. Информация по цитированию
Формат, по которому необходимо цитировать рекомендации ЕАУ, варьирует в зависимости от типа журнала. Соответственно может отличаться количество авторов или, например, данные об издателе, местоположении или номере ISBN.
Ссылка на полную версию рекомендаций оформляется следующим образом:
EAU Guidelines. Edn. presented at the EAU Annual Congress, Amsterdam, the Netherlands, 2020. ISBN 978-94-92671-07-3.
Если требуется издатель и/или местоположение:
EAU Guidelines Office, Arnhem, The Netherlands. http://uroweb.org/guidelines/compilations-of-all-guidelines/
Ссылки на отдельные рекомендации оформляются следующим образом:
Имена авторов. Название источника. Тип публикации. ISBN. Издатель и его местоположение, год.







